题目内容
6.已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,C原子基态时s电子总数与p电子总数相等,D在元素周期表的各元素中电负性最大,E元素位于元素周期表第11列.(1)ABC的第一电离能由大到小的顺学为C<O<N(用元素符号表示).
(2)AC32-的立体构型是平面正三角形,其中A原子的杂化轨道类型是sp2.
(3)A22-与C22+互为等电子体,1mol C22+中含有π键数目为2NA.
(4)用氢键表示式写出D的氢化物水溶液中存在的一种氢键F-H…F、F-H…O、O-H…F、O-H…O.
(5)基态E原子的价电子排布式为3d104s1.
(6)E的无水硫酸盐溶于水中,溶液成蓝色,原因是Cu2++4H2O=[Cu(H2O)4]2+(用离子方程式表达).
分析 A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,则B为N元素;D在元素周期表的各元素中电负性最大,则D为F元素;C原子基态时s电子总数与p电子总数相等,结合原子序数可知,C为O元素;E元素位于元素周期表第11列,则E为Cu,据此解答.
解答 解:A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,则B为N元素;D在元素周期表的各元素中电负性最大,则D为F元素;C原子基态时s电子总数与p电子总数相等,结合原子序数可知,C为O元素;E元素位于元素周期表第11列,则E为Cu.
(1)同周期随原子序数增大,越大第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较大,第一电离能高于同周期相邻元素,故第一电离能由大到小的顺序为:C<O<N,
故答案为:C<O<N;
(2)CO32-中C原子的价层电子对数为3+$\frac{4+2-2×3}{2}$=3,C原子孤对电子对数=0,CO32-为平面三角形,C原子采取sp2杂化,
故答案为:平面三角形;sp2;
(3)C22-与O22+互为等电子体,离子结构相同,O22+的电子式可表示为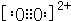 ,1mol O22+中含有的π键数目为2NA,
,1mol O22+中含有的π键数目为2NA,
故答案为:2;
(4)HF水溶液中存在的所有氢键为:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(5)E为Cu元素,基态原子的价电子排布式为3d104s1,
故答案为:3d104s1;
(6)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,溶液成蓝色,离子方程式为:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+.
点评 本题是对物质结构与性质的考查,推断元素是解题的关键,涉及核外电子排布规律、氢键、杂化理论与分子结构、配合物等,难度中等,(3)中注意等电子体中价电子总数相等,结构相似.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定存在 | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | Ba2+一定不存在,Mg2+可能存在 | D. | Cl-一定存在 |
试推测试剂A和B各是什么?(不一定填满,最少2组)
| 固体试剂A | 液体试剂B | |
| ① | ||
| ② | ||
| ③ | ||
| ④ |


①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④晶胞与金刚石相似;
⑤与干冰的晶胞相似;
⑥每个水分子平均拥有四个氢键;
⑦冰的结构是由氢键的方向性和饱和性所决定的;
⑧冰中H和O原子之间的作用力不是σ键就是氢键.
| A. | 除⑤⑥外 | B. | 除④⑦⑧外 | C. | 除④⑤⑥⑧外 | D. | 全对 |
| A. | 在放电条件下,N2和O2可直接化合生成NO | |
| B. | NO气体难溶于水 | |
| C. | 打开盛NO气体的瓶盖,立即看到瓶口有红棕色气体生成 | |
| D. | NO是红棕色气体 |
| A. | 乙醇制乙烯 | B. | 硝酸钾溶解度的测定 | ||
| C. | 实验室蒸馏石油 | D. | 煤的干馏 |
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 已知中和热为57.3 kJ•mol-1,若将1L1mol•L-1醋酸与含1molNaOH溶液混合,放出的热量要小于57.3kJ | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 |
| A. | 只存在于乙酸分子中 | B. | 只存在于乙醇分子中 | ||
| C. | 只存在于乙醇、乙酸乙酯分子中 | D. | 只存在于乙酸、乙酸乙酯分子中 |