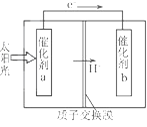
题目内容
【题目】某课题组设计实验探究SO2的性质。
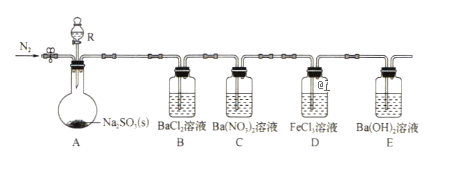
实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是__________.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:__________.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是____.
(4)探究装置C中通人SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通人过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为__________。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中, __________ | __________ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是(填字母)(_____)
A.KSCN溶液 B.NaOH溶液 C.K3[Fe(CN)6]溶液 D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH__________7(填“>”“<”或“=”)。
【答案】分液漏斗 Na2SO3+H2SO4==Na2SO4 +SO2↑+H2O 排尽装置内空气,避免O2干扰实验 3Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO+4H+ 加入铜粉(或BaCl2溶液) 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 c <
【解析】
本题考查实验方案设计与评价,(1)仪器R是分液漏斗;(2)利用硫酸酸性强于亚硫酸,装置A中制备SO2,反应方程式为Na2SO;+H2SO4=Na2SO4+SO2↑+H2O;(3)反应开始前,通入一段时间的氮气,是排除装置的空气,防止氧气干扰空气;(4)首先NO3-把SO2氧化成SO42-,本身被换成NO,反应式为2NO3-+3SO2→2NO+3SO42-,通入少量的SO2,3molSO2,能生成3molSO42-,需要3molBa2+结合成BaSO4沉淀,然后根据电荷守恒和原子守恒,离子反应方程式为:3Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO+4H+;通入过量的SO2,SO42-是过量,通入少量的SO2,溶液中有HNO3,因此具体操作是:加入铜粉(或BaCl2溶液) 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 ;(5)装置D中FeCl3可能过量,含有Fe3+,因此不能用KSCN溶液检验,检验是否含有Fe2+,应该用K3[Fe(CN)6]溶液检验,如果有蓝色沉淀生成,说明含有Fe2+,否则不含有,故选项c正确;(6)装置E产生沉淀是BaSO3,SO2在某些性质上与CO2性质相似,加入少量的盐酸,发生BaSO3+2HCl=Ba(HSO3)2+BaCl2,BaCl2溶液显中性,HSO3-电离程度大于其水解程度,溶液显酸性,即pH<7。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】下列说法正确的是
A | B | C | D |
通电一段时间后,搅拌均匀,溶液的pH增大 | 此装置可实现 铜的精炼 | 盐桥中的K+ 移向FeCl3溶液 | 若观察到甲烧杯中石墨电极附近先变红,则乙烧杯中铜电极为阳极 |
|
|
|
|
A. A B. B C. C D. D
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:

已知:i. CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 |
|
|
|
|
ii. Cr2O72-+ H2O![]() 2 CrO42-+ 2H+
2 CrO42-+ 2H+
(1)向滤液1中加入BaCl2·H2O的目的,是使CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由是________________。
③研究温度对CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42-的沉淀率![]() ,
,
如下图所示。

已知:BaCrO4(s) ![]() Ba2+ (aq) + CrO42-(aq)
Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体2中加入硫酸,回收重铬酸。
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用0.450 mol/L的硫酸时,重铬酸的回收率明显高于使用0.225 mol/L的硫酸的原因是_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_______________________________。

(3)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与___________有关。