题目内容
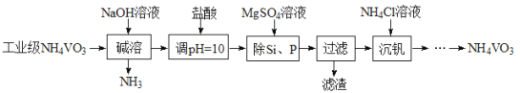
【题目】工业上利用软锰矿(主要成分为MnO2)用来制备“锰白”(MnCO3)和电极材料锰酸锂(LiO2·2MnO2·Mn2O3),期其工艺流程如下:

(1)“浸出”过程中SO2作用是__________。
(2)为使原料充分利用,滤液中c(Mn2+)应当小于__________mol·L-1。已知:常温下MnCO3的Kap=9.0×10-12。
(3)写出软锰矿与Li2CO3发生“高温还原”的化学方程式:____________。
(4)锰酸锂((LiO2·2MnO2·Mn2O3,M=362g· mol-1)中掺入LiMnO2能大幅提高电容量,实验室测定某电极材料中两者配比的操作步骤如下;准确称取2.012g的试样于锥形瓶中,加入5mL稀硫酸充分溶解;向上述所得溶液中加入10.00mL2.000mol·L-1草酸钠(Na2C2O4)标准溶液,搅拌至溶液清亮,并定容至250mL;从容量瓶中取出25.00mL溶液,用0.01mol·L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液20.00mL。
通过计算两者物质的量之比_____(写出计算过程)。
已知实验中设计的相关氧化还原反应如下:
①Mn2++C2O42-→Mn2++2CO2↑②Mn4++C2O42-→Mn2++2CO2↑
③MnO4-+C2O42-+H+→Mn2++2CO2↑(均未配平)
【答案】⑴将MnO2还原为Mn2+
⑵3.0×10-6
⑶2Li2CO3+8MnO2![]() 2Li2O·2MnO2·Mn2O3+2CO2↑+O2↑
2Li2O·2MnO2·Mn2O3+2CO2↑+O2↑
⑷ n(KMnO4)=0.01mol·L-1×0.02L×(250÷25)=0.002mol(1分)
n(Na2C2O4)=2mol·L-1×0.01L=0.02mol(1分)
设LiO2·2MnO2·Mn2O3物质的量为x,LiMnO2的物质的量为y。
362g·mol-1×x+94g·mol-1×y=2.012g
由电子守恒:6x+y+0.02mol×5=0.04mol
解得:x=0.004mol y=0.006mol(3分)
故n(LiO2·2MnO2·Mn2O3):n(LiMnO2)=2:3(1分)
【解析】(1)由所给流程图可知,SO2的作用是在酸性条件下将MnO2还原为Mn2+;
(2)根据Ksp(MnCO3)=9.0×10-12,在MnCO3饱和溶液中c(Mn2+)=c(CO32-)=![]() mol/L=3.0×10-6mol/L,为使原料充分利用,应使Na2CO3过量,故c(Mn2+)<3.0×10-6mol/L;
mol/L=3.0×10-6mol/L,为使原料充分利用,应使Na2CO3过量,故c(Mn2+)<3.0×10-6mol/L;
(3)由流程知“高温还原”时部分MnO2转化成Mn2O3,则必然有O2生成,根据电子转移守恒和元素守恒得2Li2CO3+8MnO2![]() 2Li2O·2MnO2·Mn2O3+2CO2↑+O2↑;
2Li2O·2MnO2·Mn2O3+2CO2↑+O2↑;
(4)n(KMnO4)=0.01mol·L-1×0.02L×(250÷25)=0.002mol,
n(Na2C2O4)=2mol·L-1×0.01L=0.02mol,
设LiO2·2MnO2·Mn2O3物质的量为x,LiMnO2的物质的量为y。
362g·mol-1×x+94g·mol-1×y=2.012g
由电子守恒:6x+y+0.02mol×5=0.04mol
解得:x=0.004mol 、y=0.006mol;
故n(LiO2·2MnO2·Mn2O3):n(LiMnO2)=2:3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr2O72-转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。

(1)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因_________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化化成沉淀的质量是________g。