题目内容
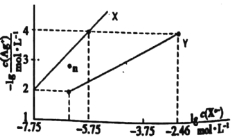
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),不能说明此反应达到平衡的标志是( )
2Z(g),不能说明此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的百分含量不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.v正(X)=2v逆(Y)
【答案】CD
【解析】
A.该反应前后的化学计量数之和不相等,容器内的压强不随时间改变,能确定反应达到平衡状态,A不符合题意;
B.若反应未达到平衡,则任何一组分的物质的量都会发生变化,物质的百分含量也会发生变化,所以若容器内各物质的百分含量不随时间变化,说明反应达到平衡状态,B不符合题意;
C.当体系达到平衡状态时X、Y、Z的浓度之比可能为l:2:2,也不能不等于l:2:2,这取决于开始加入的物质的多少及反应条件和物质的转化率,与平衡状态无关,因此不能据此确定反应处于平衡状态,C符合题意;
D.在任何条件下都存在v正(Y)=2v正(X),若v正(X)=2v逆(Y),则v正(Y)=2v正(X)=4v逆(Y),反应正向进行,未达到平衡状态,D符合题意;
故合理选项是CD。

 名校课堂系列答案
名校课堂系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1) 在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2) ⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有________________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_____________。
(4) ③、⑤、⑦、⑧形成的离子,其半径由小到大的顺序是________(填离子符号)
(5) ①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式),呈两性的氢氧化物是_________(填物质化学式);该化合物与NaOH溶液反应的离子方程式为___________。
(6) 用电子式表示元素③与⑨形成化合物的过程_____________________________。
(7)写出工业冶炼⑤的化学方程式:_______________________________________。