题目内容
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 ,下列比较中正确的是( )
,下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 ,下列比较中正确的是( )
,下列比较中正确的是( )分析:由a的原子结构示意图中最内层电子数为x,则x为2,即a原子序数为14为硅元素;从b与c形成电子式结合a、b、d同周期可知b为钠元素,c氮元素,因c、d同主族,所以d为磷元素.即a、b、c、d是四种短周期元素在周期表中位置为: ,根据元素周期律回答各选项.
,根据元素周期律回答各选项.
A、利用原子半径和元素在周期表中的位置关系来解答;
B、利用原子的氧化性变化规律来分析;
C、利用熔点和物质晶体类型关系来分析;
D、利用非金属性和最高价含氧酸关系来分析.
 ,根据元素周期律回答各选项.
,根据元素周期律回答各选项.A、利用原子半径和元素在周期表中的位置关系来解答;
B、利用原子的氧化性变化规律来分析;
C、利用熔点和物质晶体类型关系来分析;
D、利用非金属性和最高价含氧酸关系来分析.
解答:解:由a的原子结构示意图中最内层电子数为x,则x为2,即a原子序数为14为硅元素;从b与c形成电子式结合a、b、d同周期可知b为钠元素,c氮元素,因c、d同主族,所以d为磷元素.即a、b、c、d是四种短周期元素在周期表中位置为: ,
,
A、根据半径变化规律,同周期从左到右半径减小,同主族从上到下半径增大可知原子半径大小关系为:b>a>d>c,故A错误;
B、根据非金属变化规律,非金属性:N>P>Si,所以原子氧化性顺序为:c>d>a,故B错误;
C、二氧化硅为原子晶体,熔点很高,氧化钠或过氧化钠为离子晶体,熔点较高,五氧化二磷为分子晶体,熔点较低,最高价氧化物的熔点:a>b>d,故C错误;
D、硝酸为强酸,磷酸为中强酸,硅酸为弱酸,最高价含氧酸的酸性c>d>a,故D正确.
故选D.
 ,
,A、根据半径变化规律,同周期从左到右半径减小,同主族从上到下半径增大可知原子半径大小关系为:b>a>d>c,故A错误;
B、根据非金属变化规律,非金属性:N>P>Si,所以原子氧化性顺序为:c>d>a,故B错误;
C、二氧化硅为原子晶体,熔点很高,氧化钠或过氧化钠为离子晶体,熔点较高,五氧化二磷为分子晶体,熔点较低,最高价氧化物的熔点:a>b>d,故C错误;
D、硝酸为强酸,磷酸为中强酸,硅酸为弱酸,最高价含氧酸的酸性c>d>a,故D正确.
故选D.
点评:本题考查了元素推断及元素性质和元素原子结构、元素在周期表位置关系,推断元素是关键,充分利用元素在周期表中的位置和元素性质之间关系进行解题.

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为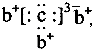 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为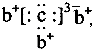 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
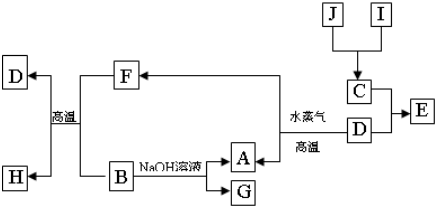
 Al(OH)3+OH-
Al(OH)3+OH-