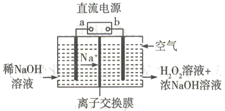
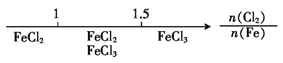
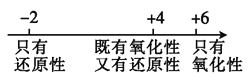
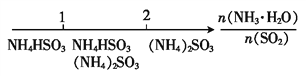��Ŀ����
����Ŀ����ͼ����ѧ��ѧ�г������ʵ�ת����ϵ���������ʺͷ�Ӧ������ȥ��
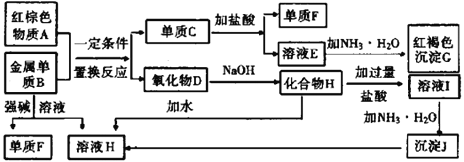
��1������Ѻ���ɫ����A���ɺ�ɫ���Ծ��壬�Ʋ��������������ȫһ�µģ���д����ɫ���Ծ�����������ᷴӦ�Ļ�ѧ����ʽ_______________________________��
��2��д������B��ǿ����Һ��Ӧ�����ӷ���ʽ��_______________________________������Һ���е���������ȫת��Ϊ����JΪʲô�Ӱ�ˮ��������������_______________��
��3����ҺE�м��백ˮʱ�������ɰ�ɫ����L��д������L�����ӷ���ʽ��_________________________����ɫ����L���ձ�Ϊ���ɫ����G��д��L��ΪG�Ļ�ѧ��Ӧ����ʽ_________________________��
��4������E��Һʱ��ΪʲôҪ���뵥��C�������ӷ���ʽ����_____________________________��
���𰸡� Fe3O4+8HCl=2FeCl3+FeCl2+4H2O 2Al+ 2OH��+ 2 H2O = 2 AlO2��+ 3 H2�� ��Ϊ��������������������ǻ�����ǿ�� Fe2++2NH3��H2O==Fe(OH)2��+2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe + 2Fe3+ = 3Fe2+
������������ɫ����AΪFe2O3�����������B��Ӧ����������D�͵���C����÷�Ӧ�����ȷ�Ӧ������B��Al��C��Fe��������D����NaOH��Ӧ��ӦΪAl2O3��HΪNaAlO2��H������Ԫ�ط�Ӧ����I����IΪAlCl3���Ȼ����백ˮ��Ӧ���ɰ�ɫ����J��JΪAl(OH)3�����������ᷴӦ�����������Ȼ���������FΪH2��EΪFeCl2���Ȼ������백ˮ��Ӧ�������ɺ��ɫ����G����GΪFe(OH)3����1����ɫ���Ծ���Ϊ��������������������ᷴӦ�Ļ�ѧ����ʽΪFe3O4+8HCl=2FeCl3+FeCl2+4H2O����2��Al���������Ƶ�ǿ����Һ��Ӧ������������Ӧ�����ӷ���ʽΪ2Al+ 2OH��+ 2 H2O = 2 AlO2��+ 3 H2������Ϊ��������������������ǻ�����ǿ���Ӧ�����ӷ���ʽΪAl(OH)3+OH-��AlO2-+2H2O����3���Ȼ������백ˮ��Ӧ������������������Ӧ�����ӷ���ʽΪFe2++2NH3��H2O==Fe(OH)2��+2NH4+��Fe(OH)2���ȶ����ڿ����б���������ɫ����Ѹ�ٱ�ɻ���ɫ�����ձ�Ϊ���ɫFe(OH)3����Ӧ�Ļ�ѧ����ʽΪ4Fe(OH)2+O2+2H2O=4Fe(OH)3����4������FeCl2��Һʱ��Ҫ���뵥��Fe����ֹ����Fe + 2Fe3+ = 3Fe2+��

 ������������ϵ�д�
������������ϵ�д�