题目内容
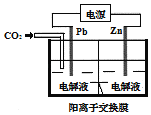
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
【答案】A
【解析】试题分析:A、紫红色斑即MnO4-向d端扩散,根据阴离子向阳极移动的原理,可知d端为阳极,即b为正极,a为负极,c为阴极,NaCl溶液中H+放电,产生OH-,c点附近会变红色,A正确;B、电解硫酸铜溶液时,Pt为阳极,溶液中的OH-放电:4OH--4e-=O2↑+2H2O,电极质量不变,Cu为阴极,溶液中的Cu2+得电子,生成铜,总反应式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,铜电极质量增加,B错误;C、随着电解的进行,Z中溶液变为硫酸溶液,再电解则为电解水,硫酸浓度增大,pH减小,C错误;D、Pt电极附近生成H+,则SO42-向Pt电极移动,D错误,D错误,答案选A。
2Cu+O2↑+2H2SO4,铜电极质量增加,B错误;C、随着电解的进行,Z中溶液变为硫酸溶液,再电解则为电解水,硫酸浓度增大,pH减小,C错误;D、Pt电极附近生成H+,则SO42-向Pt电极移动,D错误,D错误,答案选A。

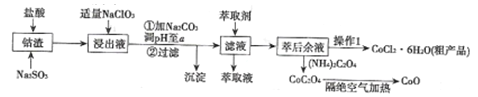
【题目】利用钻渣[含Co(OH)2、Fe2O3、Al2O3、MnO等)可以来制取钻的氧化物和CoCl2·6H2O,工艺流程如图所示:
①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为________。
(2)流程中加人适量的NaClO3的作用是___________。若加入NaClO3过量,可能产生有毒气体,写出生成该有毒气体的离子方程式___________________。
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是___________。沉淀的主要成分是______。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是________;其使用的最佳pH范围是________。
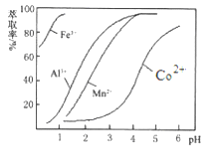
A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是______、______和过滤。
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为_______________。