题目内容
【题目】I.(1)氰化钠是剧毒化学品。氰化钠泄漏到水体中,可用ClO2处理,生成两种无色无味无毒的气体。写出用ClO2处理氰化钠废水的离子方程式____________。
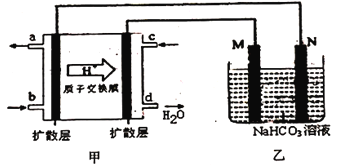
(2)中国在甲醇燃料电池技术上获得突破,其装置原理如图甲。乙池是铝制品表面“钝化”装置,两极分别为铝制品和石墨。M电极的反应式为:______________。
II.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇。已知298K和101KPa条件下:
2H2(g)+O2(g)=2H2O(1) △H1=-571.6kJ/mol
CO(g)+l/2O2(g)=CO2(g) △H2=-283.0kJ/mol
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(1) △H3=-726.5kJ/mol
(3)则CO(g)+2H2 (g)![]() CH3OH(1) △H=_____kJ/mol
CH3OH(1) △H=_____kJ/mol
(4)已知:CH3OH(1) =CH3OH(g) △H=+35.2kJ/mol;CO(g)+2H2(g)![]() CH3OH(g)平衡常数K随温度变化关系的曲线为下面左图中的_______(填曲线标记字母I或II)。
CH3OH(g)平衡常数K随温度变化关系的曲线为下面左图中的_______(填曲线标记字母I或II)。
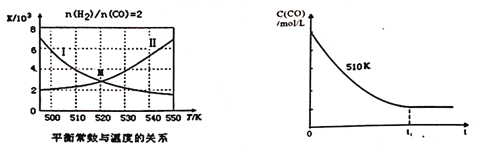
(5)维持反应温度为510K,以n(H2)/ n(CO)=2:1充入一定量的原料气于1L容器中,在上述条件下充分反应,tl时刻达到平衡,测得容器中c(CH3OH)=2mol/L,则平衡时CO转化率=______;若维持反应温度为520K,其它条件不变,请在上面右图中画出c(CO)在0~tl时刻变化曲线:_____________。
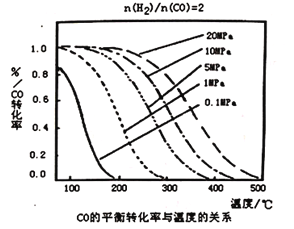
(6) 20世纪90年代,化学家研制出新型催化剂:碱金属的醇盐及溶剂用于合成甲醇。30题图4是在该新型催化剂作用下,研究温度、压强对合成甲醇的影响。由图可知适宜的反应温度、压强为____。
温度 A. 90~150℃ B. 200~260℃ C.300~360℃ D.400~460℃
压强 E. 0.1~1 MPa F.3~5 MPa G. 8~10 MPa H. 15~20MPa
【答案】 2ClO2+2CN-=2Cl-+N2+2CO2 2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O △H=-128.1kJ/mol I  97.56%(或97.6%或98%) A、F
97.56%(或97.6%或98%) A、F
【解析】I.(1)氰化钠泄漏到水体中,可用ClO2处理,生成两种无色无味无毒的气体,根据原子守恒可知应该是氮气和二氧化碳,所以用ClO2处理氰化钠废水的离子方程式为2ClO2+2CN-=2Cl-+N2+2CO2。(2)根据甲中氢离子的移动方向可知右侧电极是正极,因此M是阳极,发生失去电子的氧化反应,即铝失去电子,电极反应式为2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O;
II. (3)已知:
①2H2(g)+O2(g)=2H2O(1) △H1=-571.6kJ/mol
②CO(g)+l/2O2(g)=CO2(g) △H2=-283.0kJ/mol
③CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(1) △H3=-726.5kJ/mol
则根据盖斯定律可知①+②-③即可得到反应CO(g)+2H2 (g)![]() CH3OH(1)的反应热 △H=-128.1kJ/mol;
CH3OH(1)的反应热 △H=-128.1kJ/mol;
(4)已知:CH3OH(1) =CH3OH(g) △H=+35.2kJ/mol,则CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol,即该反应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,即曲线I符合。
CH3OH(g) △H=-92.9kJ/mol,即该反应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,即曲线I符合。
(5) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) n 2n 0
转化浓度(mol/L) 2 4 2
平衡浓度(mol/L) n-2 2n-4 2
所以根据图像可知此时平衡常数为4000,则![]() ,解得n=41/20,所以平衡时CO转化率=2/n×100%=97.56%;正反应是放热反应,升高温度反应速率加快,平衡向逆反应方向进行,CO浓度增大,到达平衡的时间减少,所以图像为
,解得n=41/20,所以平衡时CO转化率=2/n×100%=97.56%;正反应是放热反应,升高温度反应速率加快,平衡向逆反应方向进行,CO浓度增大,到达平衡的时间减少,所以图像为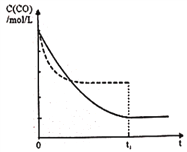 。
。
(6)根据图像可知在3~5 MPa,温度为90~150℃时CO的转化率最高,而继续升高温度或增大压强转化率变化不大,但生产成本增加,因此答案选AF。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
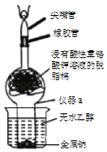
小学教材完全解读系列答案【题目】某同学对无水乙醇与金属钠的反应进行实验探究。请回答:
实验装置 | 操作步骤 | 实验现象 |
| ①用橡胶管将尖嘴管和仪器a连接,向仪器a的球形区域塞入一团脱脂棉,再向脱脂棉中滴入适量的酸性K2Cr2O7溶液 | 棉花呈橙黄色 |
②取黄豆大小的金属钠,用滤纸吸干其表面的煤油,放入小烧杯中,用仪器a的柱体部分扣住金属钠,再向小烧杯中倒入10mL左右无水乙醇,至高度没过金属钠 | ||
③反应开始20s左右,点燃尖嘴管处的气体,并在尖嘴管上方罩上内壁涂有澄清石灰水的小烧杯 | 产生明亮的淡蓝色火焰,仪器a内的脱脂棉逐渐由橙黄色变为绿色(Cr3+颜色),烧杯内壁未变浑浊 | |
④实验结束后测量反应液的温度 | 反应液的温度为52℃ |
(1)仪器a的名称是_____。
(2)请写出无水乙醇与钠反应的化学方程式:_____。
(3)下列有关该实验的说法中,正确的是_____。
A.无水乙醇与钠的反应是吸热反应
B.酸性重铬酸钾溶液的作用是除去乙醇蒸气中混有的氢气
C.仪器a的球形区域对产生的气体起到一定的富集作用,使得气体燃烧的火焰明亮,现象明显
D.操作步骤②中的现象有:加入无水乙醇后,钠表面有气泡,钠开始时沉在液体的底部,然后浮在液面上,直至消失