题目内容
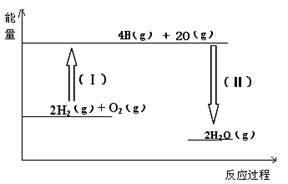
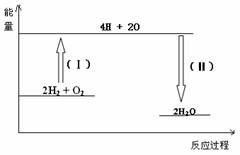
已知拆开1molH2中的化学键需要消耗436kJ能量,拆开1molO2中化学键需要消耗496kJ能量,形成水分子中1molH-O键释放463kJ能量,则下列热化学方程式正确的是( )
分析:依据热化学方程式的书写方法写出,标注物质聚集状态和对应反应的焓变,焓变△H=反应物键能之和-生成物键能之和.
解答:解:已知拆开1molH2中的化学键需要消耗436kJ能量,拆开1molO2中化学键需要消耗496kJ能量,形成水分子中1molH-O键释放463kJ能量,
则2H2+O2=2H2O中△H=436kJ×2+496kJ/mol-463kJ/mol×4=-484KJ/mol,
热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ?mol-1;
故选C.
则2H2+O2=2H2O中△H=436kJ×2+496kJ/mol-463kJ/mol×4=-484KJ/mol,
热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ?mol-1;
故选C.
点评:本题考查了热化学方程式书写方法,焓变计算应用,注意热化学方程式对应焓变的计算方法,题目较简单.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。