题目内容
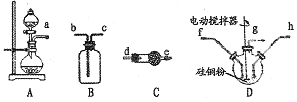
【题目】石灰石—石膏法脱硫是除去工业烟气中所含SO2的重要方法,其工艺分为两步: —是吸收产生亚疏酸氢钙,二是氧化产生石膏。某校化学兴趣小组实验模拟该工艺,设计装置如下:
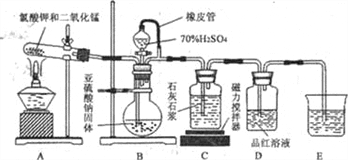
(1)装置B模拟产生含SO2的工业烟气,则E装置的作用是_______。
(2)实验开始时,打开装置B中分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中立即产生
了明显的现象,造成产生这一现象的原因是__________。
A.该装置的气密性不够好 B.滴加硫酸的速率较快
C.使用的硫酸浓度较小 D.石灰石浆液中碳酸钙粉末的顆粒太小
(3)预计当装置C中产生______的现象时,关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯。实际实验过程中却始终未观察到C中产生这一现象,小组成员多次逬行实验探究,最终发现是药品Na2SO3部分变质,请写出定性实验发现药品Na2SO3问题的有关操作及现象:取少量的亚硫酸钠固体于试管中,_____________。
(4)小组成员进一步定量实验,测量Na2SO3的纯度:
①称取12.0 g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液滴定,三次平行实验测得标准液的体积为20.00mL。则滴定终点时锥形瓶中产生的现象为_______,写出与产生终点现象有关反应的离子方程式________,样品中Na2SO3的质量分数为_________。(计算结果保留三位有效数字)。
【答案】⑴除去尾气中的SO2
⑵B
⑶由浑浊变澄清 先加适量的水溶解,再加入足量的盐酸与氯化钡溶液,有白色沉淀生成。
⑷当加入最后一滴酸性KIO3溶液时,溶液变蓝,且半分钟内不褪色 6H++5I-+IO3- = I2+3H2O 25.2%
【解析】(1)尾气中含有SO2对环境有污染,E装置中的NaOH溶液是吸收尾气中的SO2;
(2)D中立即产生了明显的现象,说明生成SO2的气流速率快,可能是滴加硫酸的速率较快,故答案B符合题意可选;
(3)石灰石浆悬浊液溶解于SO2的水溶液生成可溶性的亚疏酸氢钙,故当C中由浑浊变澄清时即可证明SO2已经过量,可关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯,通入氧气;Na2SO3部分变质后生成硫酸钠,只要检验其水溶液中含有SO42-即可,即取少量的亚硫酸钠固体于试管中,先加适量的水溶解,再加入足量的盐酸与氯化钡溶液,有白色沉淀生成;
(4)在酸性条件下IO3-氧化SO32-生成SO42-,自身还原为I-,离子反应方程式为
IO3-+3SO32-=I-+3SO42-,继续滴加酸性KIO3溶液,溶液里的I-继续被IO3- 氧化为I2,此时溶液变蓝色,发生反应的离子方程式6H++5I-+IO3- = I2+3H2O,判断滴定终点的现象为当加入最后一滴酸性KIO3溶液时,溶液变蓝,且半分钟内不褪色;根据IO3-+3SO32-=I-+3SO42-,消耗KIO3的物质的量为0.1000 mol L-1×0.02L=2×10-3mol,则Na2SO3的物质的量为2×10-3mol×3=6×10-3mol,样品中Na2SO3的质量分数为![]() ×100%=25.2%。
×100%=25.2%。

【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基(-OH)氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
由此判断下列含氧酸酸性最强的是
A. H3AsO4B. H2CrO4C. HMnO4D. H2SeO4