题目内容
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物.工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-).
反应方程式为:[Cu(NH3)2]Ac+CO+NH3 ![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 .
②氨水溶液中各元素原子的电负性从大到小排列顺序为 .
③醋酸分子中的两个碳原子,甲基(-CH3)碳和羧基(-COOH)碳的杂化方式分别是 .
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 .
a.离子键 b.配位键 c.σ键 d.π键
(2)某离子型氢化物化学式为XY2 , 晶胞结构如图 所示,其中6个Y原子(○)用阿拉伯数字1~6标注.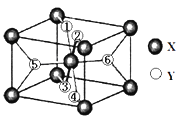
①已知1、2、3、4号Y原子在晶胞上、下面上.则5、6号Y原子均在晶胞 . (填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是 . a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
(3)一种铜合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为;若该晶体的晶胞参数为a pm,则该合金密度为g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
【答案】
(1)[Ar]3d104s1;O>N>H;sp3、sp2;abcd
(2)内部;b
(3)1∶3;![]()
【解析】(1)①Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:[Ar]3d104s1 ,
故答案为:[Ar]3d104s1;
②氨水溶液中含N、O、H三种元素,氢的电负性最小,又同周期自左而右电负性增大,故负性从大到小的排列顺序为O>N>H,
故答案为:O>N>H;
③醋酸分子中的两个碳原子,甲基(-CH3)碳采用sp2杂化,羧基(-COOH)碳采用sp2杂化,
故答案为:sp3、sp2;
④Cu2+与NH3存在配位键,NH3中N与H形成σ键,[Cu(NH3)3CO]+与Ac-之间是离子键,Ac-内有碳氧双键,所以还有π键,即存在的化学键类型为:配位键、σ键、π键和离子键,
故选abcd;
(2)①根据晶胞,X为8个顶点加一个体心一共含2个X,则由氢化物化学式为XY2 , 则该晶胞中含4个Y,又1、2、3、4号Y原子在晶胞上、下面上则算2个.则5、6号Y原子均在晶胞内部,
故答案为:内部;
②XY2晶体为离子晶体、硅烷晶体和固态氨为分子晶体,所以XY2晶体最高,而固态氨存在分子间氢键,所以固态氨的熔沸点比硅烷晶体高,
故选:b;
(3)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8× ![]() =1,Cu原子个数=6×
=1,Cu原子个数=6× ![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3;晶胞体积V=(acm)3 , 每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=
=3,所以该合金中Au原子与Cu原子个数之比=1:3;晶胞体积V=(acm)3 , 每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=  gcm-3=
gcm-3= ![]() gcm-3;
gcm-3;
故答案为:1:3; ![]() 。(1)①根据电子排布规律进行书写;②根据同周期元素的电负性变化规律进行判断;③根据甲基和羧基的结构判断杂化方式;④根据配合物的结构判断化学键类型;
。(1)①根据电子排布规律进行书写;②根据同周期元素的电负性变化规律进行判断;③根据甲基和羧基的结构判断杂化方式;④根据配合物的结构判断化学键类型;
(2)根据均摊法计算化学式,然后分析原子的位置;根据氢键对沸点的影响进行判断;
(3)根据均摊法计算。

【题目】已知反应X(g)+Y(g) ![]() R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(Ls).下列说法正确的是( )
R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(Ls).下列说法正确的是( )
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A.4s时容器内c(Y)=0.76 mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
