题目内容
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ![]() ×100%
×100%
②c= ![]()
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A.①③
B.②③
C.①②
D.只有②
【答案】D
【解析】①氨气溶于水,主要以NH3H2O存在,但仍然以NH3作为溶质,ω= ![]() ×100%=
×100%= ![]() ×100%=
×100%= ![]() ×100%,故①不符合题意;
×100%,故①不符合题意;
②所得氨水中溶液的物质的量浓度为:c= ![]() =
= ![]() mol/L,故②符合题意;
mol/L,故②符合题意;
③溶质质量分数= ![]() ×100%=
×100%= ![]() =
= ![]() ×w,由于氨水的密度小于水,则ρ
×w,由于氨水的密度小于水,则ρ ![]() <0.5,
<0.5,
所得氨水的质量分数<0.5w,故③不符合题意;
所以答案是:D.

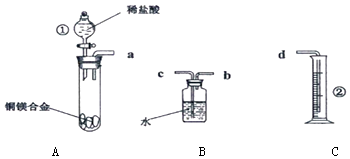
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3 , 钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1: 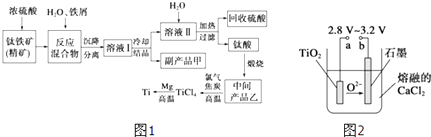
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4 , 反应中无气体生成.副产品甲阳离子是 .
(2)上述生产流程中加入铁屑的目的是 .
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10﹣16 | 1.0×10﹣29 | 1.8×10﹣11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018molL﹣1 , 当溶液的pH等于时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是 .
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的极,阴极的电极反应式 .
【题目】短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是
X | ||
Y | ||
Z |
A. X,Y,Z中X的单质最稳定B. Y的氢化物为HY
C. X能生成HXOD. 能发生Cl2+H2Z = Z+2HCl的反应
【题目】下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | N2 | NO | NO2 | HNO3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Na | NaOH | Na2CO3 | NaHCO3 |
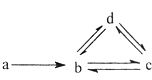
A.①②
B.②③
C.③④
D.②④