题目内容
【题目】按要求完成下列问题
(1)写出下列反应的离子方程式:MnO2+4HCl═MnCl2+Cl2↑+2H2O
(2)将离子方程式改写成化学方程式:2OH﹣+Mg2+═Mg(OH)2↓
(3)用双线桥表示电子转移情况,Fe2O3+3CO═2Fe+3C O2该反应的氧化产物是
(4)用单线桥表示电子转移情况 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O该反应的氧化剂是 .
【答案】
(1)MnO2+4H++2Cl﹣═Mn2++Cl2↑+2H2O
(2)2NaOH+MgCl2═Mg(OH)2↓+2NaCl
(3)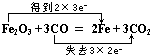 ,CO2
,CO2
(4)![]() ,HNO3
,HNO3
【解析】解:(1)氧化物形成化学式形式,氯化锰、HCl改写成离子形式,反应离子方程式为:MnO2+4H++2Cl - ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)2OH﹣+Mg2+═Mg(OH)2↓可表示氢氧化钠与氯化镁反应,化学方程式:2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
(3)Fe2O3+3CO═2Fe+3C O2该反应中一氧化碳中的C化合价升高,所以CO为还原剂,对应产物CO2为氧化产物,该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为 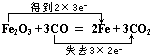 ,
,
(4)3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O中,Cu元素的化合价由0升高为+2价,即Cu元素的化合价升高,被氧化,Cu为还原剂,发生氧化反应;N元素的化合价由+5价降低为+4价,则HNO3为氧化剂;
该反应中转移6e﹣,所以单线桥表示反应的电子转移的方向和数目 ![]() ,
,
所以答案是:(1)MnO2+4H++Cl- ![]() Mn2++Cl2↑+2H2O;(2)2 NaOH+MgCl2═Mg(OH)2↓+2NaCl;(3)
Mn2++Cl2↑+2H2O;(2)2 NaOH+MgCl2═Mg(OH)2↓+2NaCl;(3)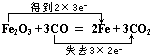 ;(4)
;(4)![]() ;HNO3;
;HNO3;

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】在Na+浓度为0.5molL﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO | CO | SiO | SO |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是;
(2)实验Ⅰ中生成气体的离子方程式为;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
阴离子 | NO | CO | SiO | SO |
c/molL﹣1 |


