题目内容
【题目】在A1C13和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为l L)

则下列判断正确的是
A. 图中线段oa:ab=3:l B. NaOH溶液物质的量浓度为0.6 mol·L-1
C. 在b点处溶液中的溶质只有NaAlO2 D. 混合溶液中Al3+与Mg2+物质的量比值为2:1
【答案】B
【解析】A、AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,加入aLNaOH溶液时,沉淀达最大值共0.2mol,此时溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,在aL时,再继续滴加NaOH溶液(b-a)L时,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液,所以两部分NaOH溶液的体积之比等于消耗的NaOH的物质的量之比,即为n(NaCl)与n(NaAlO2)之比,故oa:ab=a:(b-a)=0.5mol:0.1mol=5:1,A错误。B、在bL时,溶液为NaCl、NaAlO2溶液,由图象可知:n[Al(OH)3]=0.1mol,n(Mg(OH)2]=0.1mol,根据Mg原子守恒有n(MgCl2)=n(Mg(OH)2]=0.1mol,根据Al原子守恒有n(NaAlO2)=n(AlCl3)=n[Al(OH)3]=0.1mol,由Cl原子守恒有n(Cl)=n(NaCl)=2n(MgCl2)+3n(AlCl3)=2×0.1mol+3×0.1mol=0.5mol,由Na原子守恒有n(NaOH)=n(NaCl)+n(NaAlO2)=0.5mol+0.1mol=0.6mol,所以c(NaOH)=0.6mol÷1L=0.6mol/L,B正确;C、在aL时,再继续滴加NaOH溶液(b-a)L时,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液,C错误;D、根据以上分析可知混合溶液中Al3+与Mg2+物质的量比值为1:1,D错误;答案选B。

【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
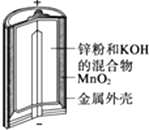
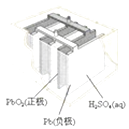
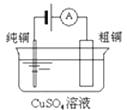
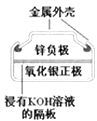
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag