��Ŀ����
����Ŀ������ʵ��������ʵ����ʵ��������ȷ���м����� ��
����Ũ��ˮ��ϴ�����Ʊ�AgCl��Ӧ����Թܣ�������һ�����ʵ���Ũ�ȵ���Һʱ��δ��ҡ������ҺŨ��ƫ�ߣ�����ʪ���pH��ֽ�ⶨϡ�����pH�����ü�ʽ�ζ�����ȡ20.00mL0.1mol/LKMnO4��Һ���ݽ�Na2CO3�����ڴ������м������ڣ�������������Һմ��Ƥ���ϣ�������NaOHϡ��Һ��ϴ��������ڵ�NaOH��Һ�еμ�FeCl3��Һ�Ʊ�Fe(OH)3���壻������FeSO4��Һʱ��������������ۺ�ϡ����
A.1B.2C.3D.4
���𰸡�B
��������
![]() ���ڰ�ˮ���Ȼ������Է�Ӧ�γ�������Һ���ʿ���Ũ��ˮ��ϴ�����Ʊ�AgCl��Ӧ����Թܣ���
���ڰ�ˮ���Ȼ������Է�Ӧ�γ�������Һ���ʿ���Ũ��ˮ��ϴ�����Ʊ�AgCl��Ӧ����Թܣ���![]() ��ȷ��
��ȷ��
![]() ����һ�����ʵ���Ũ�ȵ���Һʱ��δ��ҡ������ҺŨ��ƫ�ߣ���
����һ�����ʵ���Ũ�ȵ���Һʱ��δ��ҡ������ҺŨ��ƫ�ߣ���![]() ��ȷ��
��ȷ��
![]() ��ֽ����ʪ����ʪ���pH��ֽ�ⶨϡ�����pH���ᵼ��ϡ���ᱻϡ�ͣ��ⶨ���ƫ�ߣ���
��ֽ����ʪ����ʪ���pH��ֽ�ⶨϡ�����pH���ᵼ��ϡ���ᱻϡ�ͣ��ⶨ���ƫ�ߣ���![]() ����
����
![]() �ü�ʽ�ζ�����ȡ
�ü�ʽ�ζ�����ȡ![]()
![]() ��Һ����ʽ�ζ��ܵ��ܻᱻ���������Һ������Ӧ��ʹ����ʽ�ζ�����ȡ����
��Һ����ʽ�ζ��ܵ��ܻᱻ���������Һ������Ӧ��ʹ����ʽ�ζ�����ȡ����![]() ����
����
![]() ��Na2CO3�����ڴ������м������ڣ�̼�����ܹ��������еĶ������跴Ӧ��Ӧ��ʹ������������
��Na2CO3�����ڴ������м������ڣ�̼�����ܹ��������еĶ������跴Ӧ��Ӧ��ʹ������������![]() ����
����
![]() �������ƾ���ǿ�ҵĸ�ʴ�ԣ����Բ����ô�����NaOHϡ��Һ��ϴ�������þƾ�ϴȥ����
�������ƾ���ǿ�ҵĸ�ʴ�ԣ����Բ����ô�����NaOHϡ��Һ��ϴ�������þƾ�ϴȥ����![]() ����
����
![]() ����ڵ�NaOH��Һ�еμ�FeCl3��Һ����Ӧ���ɵ������������������Ʊ�������������ķ���Ϊ���������Ȼ�����Һ���뵽��ˮ�У�����������Һ��ʺ��ɫ����
����ڵ�NaOH��Һ�еμ�FeCl3��Һ����Ӧ���ɵ������������������Ʊ�������������ķ���Ϊ���������Ȼ�����Һ���뵽��ˮ�У�����������Һ��ʺ��ɫ����![]() ����
����
![]() ����FeSO4��Һʱ��Ϊ�˷�ֹ�������ӱ���������Ҫ�����������ۣ�Ϊ�������������ӵ�ˮ�⣬����Ҫ��������ϡ���ᣬ�ʴ���
����FeSO4��Һʱ��Ϊ�˷�ֹ�������ӱ���������Ҫ�����������ۣ�Ϊ�������������ӵ�ˮ�⣬����Ҫ��������ϡ���ᣬ�ʴ���
�������Ϸ�����֪��������ȷ����2������B��ȷ��
��ѡB��

����Ŀ����ҵ�����̶���������CO2����Ч�ؼ���������ЧӦ����
I����ҵ�������о�����CO2�������״�ȼ�ϵķ������÷����Ļ�ѧ����ʽ�ǣ�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-49.0kJmol��1��ij��ѧʵ�齫6molCO2��8 molH2����һ�ݻ�Ϊ2L���ܱ�������(�¶ȱ��ֲ���)�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩��
CH3OH(g)+H2O(g) ��H=-49.0kJmol��1��ij��ѧʵ�齫6molCO2��8 molH2����һ�ݻ�Ϊ2L���ܱ�������(�¶ȱ��ֲ���)�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩��
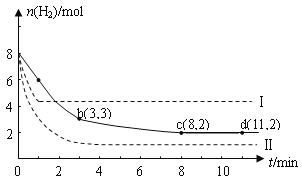
�ش��������⣺
��1������˵������ȷ������__________��
A��0��1min��ƽ����Ӧ���ʴ���3��4min��ƽ����Ӧ����
B���ﵽƽ��ʱH2��ת����Ϊ75%
C�� ��������������ʱ������߷�Ӧ���¶�����Ӧ���������淴Ӧ���ʼ�С
��2���÷�Ӧ��0 ��8 min��CO2��ƽ����Ӧ������_______��
��3���÷�Ӧ��ƽ�ֳ���K=______________��
��4�����ı�ijһ�����ٽ���ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ����ʵ����ȣ�����I�ı������������_________����ʵ�߶�Ӧ������ƽ�ⳣ��ΪK������I��Ӧ������ƽ�ⳣ��ΪK1������II��Ӧ������ƽ�ⳣ��ΪK2����K��K1��K2�Ĵ�С��ϵ��____��
II����֪25��ʱ�������̼��ĵ���ƽ�ⳣ�����±���
���ʵĻ�ѧʽ | CH3COOH | H2CO3 | |
����ƽ�ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 | K2=5.6��10��11 |
��1���ñ��Ͱ�ˮ����CO2�ɵõ�NH4HCO3��Һ������֪CH3COONH4��ҺpH=7����(NH4)2CO3��Һ��_____(������������������������������)��
��2��25��ʱ����0��lmolL��1������Һ�м���һ������NaHCO3�������¶Ȳ��䣬���û��Һ��pH=6����ô���Һ��![]() =_______���û����Һ�е�����Ũ���ɴ�С��˳��Ϊ��________________��
=_______���û����Һ�е�����Ũ���ɴ�С��˳��Ϊ��________________��