题目内容
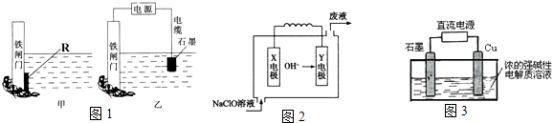
【题目】为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验( 夹持仪器 已略去,装置气密性已检验)。
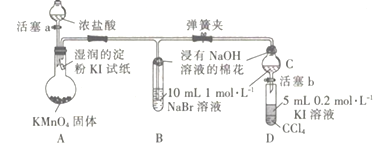
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)装置A 中发生的置换反应的化学方程式为___________________。
(2)装置B的溶液中NaBr完全被氧化,则消耗Cl2 的物质的量为_______________。
(3)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是_____________________。
(4)氯水和二氧化硫气体均有漂白作用,但两者混合使用却失去漂白作用,其原因是___________________ (用离子方程式表示)。
(5)设计实验方案证明Fe3+的氧化性比I2 强(写出实验操作过程、实验现象与结论):____________________________________。
【答案】 Cl2+2KI=I2+2KCl 0.005mol 打开活塞b,将装置C中的少量溶液滴入装置D中,然后关闭活塞b,取下装置D振荡,静置后CCl4层变为紫红色 Cl2+SO2+2H2O=4H++2Cl-+SO42- 取一支试管,往其中加入一定量的KI溶液和淀粉溶液,然后再向试管中加入FeCl3溶液,若溶液变蓝色,则证明Fe3+的氧化性比I2强(或其他合理答案)
【解析】(1)A中高锰酸钾与浓盐酸反应生成氯气,氯气具有氧化性,则装置A中发生的置换反应的化学方程式为Cl2+2KI=I2+2KCl。(2)装置B的溶液中NaBr是0.01mol,根据电子得失守恒可知完全被氧化时消耗Cl2的物质的量为0.01mol÷2=0.005mol。(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色,其中紫红色为I2溶解在CCl4呈现的颜色;(4)氯水和二氧化硫气体均有漂白作用,但两者混合使用却失去漂白作用,其原因是二者发生了氧化还原反应生成硫酸和盐酸,离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-。(5)根据碘遇淀粉显蓝色可知证明Fe3+的氧化性比I2强的实验操作过程、实验现象与结论是:取一支试管,往其中加入一定量的KI溶液和淀粉溶液,然后再向试管中加入FeCl3溶液,若溶液变蓝色,则证明Fe3+的氧化性比I2强。

【题目】下列各组物质中,不能按(“→”表示一步完成)关系相互转化的是
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | Cl2 | NaClO | NaCl |
C | Si | SiO2 | H2SiO3 |
D | AlCl3 | Al(OH)3 | NaAlO2 |
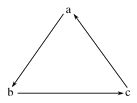
A. A B. B C. C D. D