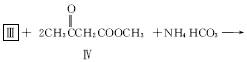题目内容
甲酸的下列性质中,可以证明它是弱电解质的是( )
分析:A、甲酸溶液使紫色石蕊试液变红与电解质的强弱无关;
B、电解质的强弱与溶解性的大小无关;
C、酸碱是否完全反应取决于二者的物质的量的关系,与是否强弱电解质无关;
D、根据PH的大小判断是否完全电离,若完全电离,是强电解质,反之是弱电解质.
B、电解质的强弱与溶解性的大小无关;
C、酸碱是否完全反应取决于二者的物质的量的关系,与是否强弱电解质无关;
D、根据PH的大小判断是否完全电离,若完全电离,是强电解质,反之是弱电解质.
解答:解:A、甲酸溶液使紫色石蕊试液变红,说明甲酸具有酸性,不能证明甲酸是弱电解质,故A错误;
B、溶解性与电解质强弱无关,故B错误;
C、完全反应与强弱无关,故C错误;
D、如果是强电解质应该完全电离,那么H+浓度应该是1mol/L 而不是约为1×10-2 mol/L 说明甲酸不能完全电离,肯定是弱电解质,故D正确;
故选D.
B、溶解性与电解质强弱无关,故B错误;
C、完全反应与强弱无关,故C错误;
D、如果是强电解质应该完全电离,那么H+浓度应该是1mol/L 而不是约为1×10-2 mol/L 说明甲酸不能完全电离,肯定是弱电解质,故D正确;
故选D.
点评:本题考查电解质的强弱判断的角度,题目难度不大,可从以下角度证明某种物质是弱电解质:
以盐酸和醋酸为例,介绍几种鉴别强电解质和弱电解质的方法.
1、通过测定同浓度、同体积的溶液的导电性强弱来鉴别;
2、通过测定同浓度溶液的pH大小来鉴别;
3、通过比较同浓度、同体积的溶液与同一种物质反应的速率快慢来鉴别;
4、通过测定同浓度的酸所对应的钠盐溶液的pH大小来鉴别;
5、通过比较体积相同、pH相同的酸溶液同倍数稀释后,溶液的pH变化大小来鉴别;
6、通过比较同体积、同pH的溶液分别与同种物质发生完全反应时,消耗的物质的量的多少来鉴别;
7.通过向酸溶液中加入与之相应的钠盐,引起溶液PH变化的大小来鉴别.
以盐酸和醋酸为例,介绍几种鉴别强电解质和弱电解质的方法.
1、通过测定同浓度、同体积的溶液的导电性强弱来鉴别;
2、通过测定同浓度溶液的pH大小来鉴别;
3、通过比较同浓度、同体积的溶液与同一种物质反应的速率快慢来鉴别;
4、通过测定同浓度的酸所对应的钠盐溶液的pH大小来鉴别;
5、通过比较体积相同、pH相同的酸溶液同倍数稀释后,溶液的pH变化大小来鉴别;
6、通过比较同体积、同pH的溶液分别与同种物质发生完全反应时,消耗的物质的量的多少来鉴别;
7.通过向酸溶液中加入与之相应的钠盐,引起溶液PH变化的大小来鉴别.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
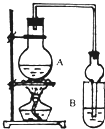
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)A中浓硫酸的作用是
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
(4)反应结束后D中的现象是
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰.
 ,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

 代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为
代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为
 其合成原料2-呲啶甲酸的结构式为
其合成原料2-呲啶甲酸的结构式为