题目内容
【题目】

⑴如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,本实验所需玻璃仪器E规格为 mL。
⑵下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
C.用来加热溶解固体溶质 | D.量取一定体积的液体 |
⑶在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线, 则所配制溶液浓度 0.1 mol/L(填“大于”“等于”或“小于”,下同);若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 0.1 mol/L。
⑷由计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
【答案】(1)A C; 分液漏斗;500ml(2)BCD;(3)小于; 大于;(4) 13.6;25
【解析】试题分析:(1)配制一定物质的量浓度溶液需要的仪器有托盘天平、量筒、烧杯、玻璃棒、容量瓶和胶头滴管,因此不需要的是烧瓶和分液漏斗,其中C是分液漏斗,E是容量瓶,该实验中需要500mL容量瓶。
(2)A.容量瓶可用来配制一定体积准确浓度的标准溶液,A正确;B.容量瓶不能长期贮存溶液,B错误;C.容量瓶不能用来加热溶解固体溶质,C错误;D. 容量瓶不能量取一定体积的液体,D错误,答案选BCD。
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线, 则溶液体积增加,因此所配制溶液浓度小于0.1 mol/L;若NaOH溶液未冷却即转移至容量瓶定容,则冷却后溶液体积减小,因此所配制溶液浓度大于0.1 mol/L。
(4)硫酸的物质的量是0.5L×0.5mol/L=0.25mol,因此所需质量分数为98%、密度为1.84 g/cm3的浓硫酸体积为![]() ,所以需要25mL量筒。
,所以需要25mL量筒。

 名校课堂系列答案
名校课堂系列答案【题目】
I.某化学兴趣小组对下列三组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.溶液、水、悬浊液、胶体
C.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
请你帮他们完善下列空白:
A | B | C | |
分类标准 | 含氧酸 | 分散系 | (3) |
不属于该类别的物质 | (1) | (2) | Na2CO3 |
II.“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
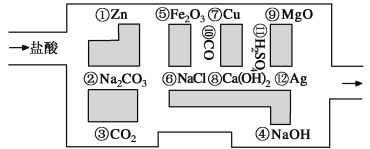
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是____________,写出该反应的离子方程式 。

