题目内容
已知在100 ℃的温度下,水的离子积KW=1×10-12。本题涉及的溶液,其温度均为100 ℃,下列说法中正确的是( )
| A.0.005 mol·L-1的H2SO4溶液,pH=2 |
| B.0.001 mol·L-1的NaOH溶液,pH=11 |
| C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 |
| D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL |
A
本题考查的主要内容是有关KW=c(H+)·c(OH-)的计算、pH=-lg{c(H+)}的计算和酸碱中和反应的计算,c(H+)、pH与溶液酸碱性的关系。
A选项c(H+)="0.005" mol·L-1×2="0.01" mol·L-1,pH=-lg{c(H+)}=-lg0.01=-lg(1×10-2)=2。
B选项c(OH-)="0.001" mol·L-1,c(H+)=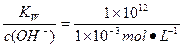 =1×10-9 mol·L-1,pH=-lg(1×10-9)=9。
=1×10-9 mol·L-1,pH=-lg(1×10-9)=9。
C选项该项中提供的H2SO4溶液与NaOH溶液恰好完全中和。由于100 ℃溶液中c(H+)·c(OH-)=1×10-12,故c(H-)=c(OH-)=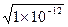 =1×10-6 mol·L-1,pH=6。虽然pH=6,但溶液不是酸性。问题的关键是c(H+)=c(OH-),溶液应该是显中性。
=1×10-6 mol·L-1,pH=6。虽然pH=6,但溶液不是酸性。问题的关键是c(H+)=c(OH-),溶液应该是显中性。
D选项c(H+)="0.001" mol·L-1,n(H+)="0.05" L×0?001 mol·L-1="0.000" 05 mol。pH=11的50 mL NaOH溶液中,c(H+)=1×10-11 mol·L-1,c(OH-)="0.1" mol·L-1,n(OH-)="0.05" L×0.1 mol·L-1="0.005" mol。两溶液混合反应后,NaOH过量。中和H2SO4所需要的NaOH溶液小于50 mL。
A选项c(H+)="0.005" mol·L-1×2="0.01" mol·L-1,pH=-lg{c(H+)}=-lg0.01=-lg(1×10-2)=2。
B选项c(OH-)="0.001" mol·L-1,c(H+)=
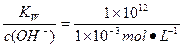 =1×10-9 mol·L-1,pH=-lg(1×10-9)=9。
=1×10-9 mol·L-1,pH=-lg(1×10-9)=9。C选项该项中提供的H2SO4溶液与NaOH溶液恰好完全中和。由于100 ℃溶液中c(H+)·c(OH-)=1×10-12,故c(H-)=c(OH-)=
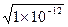 =1×10-6 mol·L-1,pH=6。虽然pH=6,但溶液不是酸性。问题的关键是c(H+)=c(OH-),溶液应该是显中性。
=1×10-6 mol·L-1,pH=6。虽然pH=6,但溶液不是酸性。问题的关键是c(H+)=c(OH-),溶液应该是显中性。D选项c(H+)="0.001" mol·L-1,n(H+)="0.05" L×0?001 mol·L-1="0.000" 05 mol。pH=11的50 mL NaOH溶液中,c(H+)=1×10-11 mol·L-1,c(OH-)="0.1" mol·L-1,n(OH-)="0.05" L×0.1 mol·L-1="0.005" mol。两溶液混合反应后,NaOH过量。中和H2SO4所需要的NaOH溶液小于50 mL。

练习册系列答案
相关题目
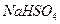 在水中的电离方程式为
在水中的电离方程式为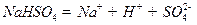 。在
。在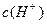 __________
__________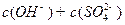 (填“>”“=”或“<”,1分)。
(填“>”“=”或“<”,1分)。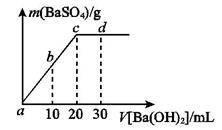
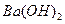 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________(2分)。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________(2分)。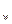 为__________(1分),在该溶液中由水电离出的
为__________(1分),在该溶液中由水电离出的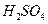 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________(2分),此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________(2分)。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________(2分),此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________(2分)。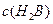 、②
、②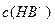 、③
、③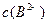 由大到小的顺序为_______________(2分)。
由大到小的顺序为_______________(2分)。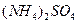 溶液、②
溶液、②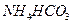 溶液、③
溶液、③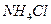 溶液中,
溶液中,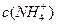 由大到小的排列顺序为_______________________(2分)。
由大到小的排列顺序为_______________________(2分)。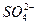 、
、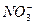 、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则 、SO
、SO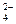
 、NO
、NO