题目内容
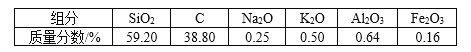
【题目】1-36号A、B、C、D、E、F六种元素,其中A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,D原子的价电子排布为ns2np2n+2,E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540。F2+离子K、L、M层全充满。根据以上信息,同答下列问题:
(1)BA4D和BA2D,沸点较高的是________(填相关物质的结构简式)
(2)已知B与A形成的化合物在标准状况下的密度为1.16g·L-1,则在该化合物分子空间构型_________,在该化合物分子中含有σ键和π键个数比__________。
(3)写出单质F与足量C的最高价氧化物对应的水化物稀溶液反应,C被还原到最低价,该反应的化学方程式________________________
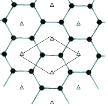
(4)B的单质是一种层状结构,元素B和E的形成一种合金,E的原子位于B的层间,其投影位于层面六圆环的中央,“△”表示E的原子位置,平行四边形表示在此二维图形上画出的一个晶胞,该合金的化学式为_______________________。
【答案】 CH3OH 直线 3:2 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O MgC2
【解析】A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为碳元素,D原子的价电子排布为ns2np2n+2,则D为氧元素,则C为氮元素,E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540,说明E最外层有2个电子,原子序数大于氧小于18,则E为镁元素,F2+离子K、L、M层全充满,则F为30号元素,锌元素,(2)中B(碳)与A形成的化合物在标准状况下的密度为1.16g·L-1,则该化合物的相对分子质量为26,所以该化合物为C2H2,则A为氢元素,据此答题。
根据以上分析结果,
(1) BA4D和BA2D分别为CH3OH和HCHO,因为CH3OH分子之间可以形成氢键,所以CH3OH沸点较HCHO高,
因此,本题正确答案是:CH3OH;
(2)由C、H元素形成的化合物在标准状况下的密度为1.16g·L-1,则该化合物的相对分子质量为26,所以该化合物为C2H2,分子空间构型为直线型,在C2H2中含有3个σ键和2个π键,所以σ键和π键个数比为3:2,因此,本题正确答案是:直线; 3:2;
(3)锌与稀硝酸溶液反应,氮被还原到最低价,生成硝酸铵,该反应的化学方程式为4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O ,
因此,本题正确答案是:4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O ;
(4)以图中一个六边形为例,该六边形中实际占有的碳原子数为6![]() =2,含有的镁原子数为1,该合金的化学式为MgC2,
=2,含有的镁原子数为1,该合金的化学式为MgC2,
因此,本题正确答案是: MgC2。

【题目】下表是元素周期表的一部分,针对表中的①~⑧元素回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ④ | ⑤ | ⑥ | |||||
三 | ① | ② | ③ | ⑦ | ⑧ |
(1)在这些元素原子中,失电子能力最强的是____(填元素符号),非金属性最强的元素是___(填元素符号)。
(2)单质化学性质最不活泼的元素是______(填元素符号),其原子结构示意图为_____。
(3)元素的最高价氧化物对应的水化物中,呈两性的是_______(填化学式)。
(4)⑤、⑥所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是_________(填化学式)。
(5)在②、⑥、⑦三种元素中原子半径按从大到小的是_______(填元素符号)表中元素最高价氧化物对应的水化物中,酸性最强的是_________(填化学式)。
(6)写出元素③的单质与稀盐酸反应的化学方程式____________。