题目内容
(10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-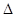 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)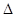 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)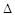 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的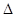 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
(3)已知:2NO2(g) N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变);
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)

(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
(1)合成氨反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。(2)已知:O2(g) = O2+(g)+e-
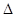 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1PtF6(g)+e-=PtF6-(g)
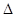 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1O2PtF6(S)=O2+(g)+PtF6-(g)
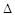 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1则反应O2(g)+PtF6(g) = O2+PtF6-(s)的
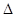 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。(3)已知:2NO2(g)
 N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变);
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的物质的量 | D.升高温度 |
(1)向左 不改变 (2)-77.6 (3)c(N2O4)/c2(NO2) 减小 BC
(4)中
(4)中

(1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。
(2)根据盖斯定律,将化学方程式①+②-③叠加即得到O2(g)+PtF6(g) = O2+PtF6-(s)。
(3)平衡常数是指在一定条件下的可逆反应中,当反应达到平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值。因为反应是放热反应,所以升高温度,平衡向逆反应方向移动,平衡常数减小。减小反应物浓度平衡向逆反应方向移动,转化率降低。温度降低平衡向正反应方向移动,转化率增大,升高温度正好相反。因为反应物和生成物都只有一种,所以增加NO2的物质的量,相当于增大压强,平衡向正反应方向移动,转化率增大。
(4)由溶液的电荷守恒可得: c(H*)+c(NH4*)=c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数
Kb=[c(NH4*)·c(OH-)]/c(NH3·H2O)=(0.01mol·L-1·10-7mol·L-1)/(amol·L-1-0.01mol·L-1)
= 10-9/( (a-0.01)mol·L-1。
(2)根据盖斯定律,将化学方程式①+②-③叠加即得到O2(g)+PtF6(g) = O2+PtF6-(s)。
(3)平衡常数是指在一定条件下的可逆反应中,当反应达到平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值。因为反应是放热反应,所以升高温度,平衡向逆反应方向移动,平衡常数减小。减小反应物浓度平衡向逆反应方向移动,转化率降低。温度降低平衡向正反应方向移动,转化率增大,升高温度正好相反。因为反应物和生成物都只有一种,所以增加NO2的物质的量,相当于增大压强,平衡向正反应方向移动,转化率增大。
(4)由溶液的电荷守恒可得: c(H*)+c(NH4*)=c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数
Kb=[c(NH4*)·c(OH-)]/c(NH3·H2O)=(0.01mol·L-1·10-7mol·L-1)/(amol·L-1-0.01mol·L-1)
= 10-9/( (a-0.01)mol·L-1。

练习册系列答案
相关题目
 2AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是
2AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是
 1/2N2(g)+CO2(g)△H="-373.2" kJ/mol。达到平衡后,为了提高该反应的速率和NO的转换率,采取的措施正确的是( )
1/2N2(g)+CO2(g)△H="-373.2" kJ/mol。达到平衡后,为了提高该反应的速率和NO的转换率,采取的措施正确的是( ) 2NH3,已达平衡状态的是( )
2NH3,已达平衡状态的是( ) pC(g)+qD(g)
pC(g)+qD(g)
 CO(g)+H2O(g),
CO(g)+H2O(g),