题目内容
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是( )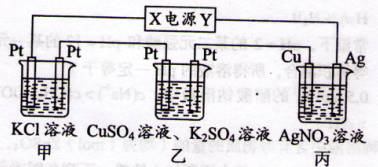
| A.乙中左侧电极反应式:Cu2++2e-=Cu |
| B.电解过程中装置丙的pH无变化 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.当甲装置中产生标准状况下4.48 L气体时,Cu电极上质量增加43.2 g |
D
解析试题分析:A、乙装置的左侧电极质量增加,则左侧为阴极,由此可确定X极为负极,Y为正极,乙装置中铜离子放电,对;B、装置内阴极析出银单质,阳极上的银失去电子变成银离子,理论上溶液的物质的量浓度不变,pH保持不变,对;C、装置甲中开始的反应为:2KCl+2H2O2KOH+H2↑+Cl2↑,故要使溶液恢复可通入适最HCl气体即可,对;D、由装置甲发生的反应可得两电极产生的气体体积相等,所以产生氢气为2.24 L,转移电子0.2 mol,则铜电极上生成Ag0.2 mol,质量为21.6 g,错。
考点:考查电化学基础,涉及电解和电镀。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
利用下图密封装置进行实验,起初a、b两处液面相平,放置一段时间。下列说法正确的是
| A.a中发生析氢腐蚀,b中发生吸氧腐蚀 |
| B.一段时间后,a中液面低于b中液面 |
| C.a中溶液的pH增大,b中溶液的pH减小 |
| D.a、b中负极的电极反应式均为Fe-2e-=Fe2+ |
用石墨作电极,电解1 mol / L下列物质的溶液,溶液的pH值保持不变的是
| A.HCl | B.NaOH | C.K2SO4 | D.NaCl |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价) 和H2O2作原料的燃料电池,负极材料采用Pt/C, 正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示,下列说法正确的是( ) 
| A.电池放电时,Na+从b极区移向a极区 |
| B.电极a采用MnO2,放电时它被还原 |
| C.该电池负极的电极反应式为:BH4-+8OH––8e– = BO2-+6H2O |
| D.放电时,a极区溶液的pH升高,b极区溶液pH降低 |
实验装置如图所示。下列说法正确的是
| A.该装置不能发生原电池反应 |
| B.活性炭是阴极 |
| C.总反应为:4Al+3O2 +6H2O → 4Al(OH)3 |
| D.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为:x Mg+Mo3S4 MgxMo3S4
MgxMo3S4
下列说法错误的是
| A.放电时Mg2+向正极迁移 |
| B.放电时正极反应为:Mo3S4+2xe-=Mo3S42x- |
| C.充电时Mo3S4发生氧化反应 |
| D.充电时阴极反应为:Mg2++2e-=Mg |
关于下图装置的叙述中正确的是( )
| A.电流由铁钉经过导线流向石墨棒 |
| B.该装置是一个简易的电解饱和食盐水的装置 |
C.石墨棒上发生的电极反应式: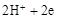 → →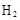 ↑ ↑ |
D.石墨棒上发生的电极反应式: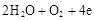 → →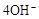 |
用Pt做电极,电解含C(Cu2+): C(Na+): C(Cl-)=1:2:4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是
| A.阴极:2H++2e-=H2↑阳极:4OH-- 4e-=2H2O+O2↑ |
| B.阴极:2H++2e-=H2↑阳极:2Cl--2e-=Cl2↑ |
| C.阴极:Cu2++2e-=Cu阳极:4OH-- 4e-=2H2O+O2↑ |
| D.阴极:Cu2++2e-="Cu" 阳极:2Cl--2e-=Cl2↑ |
