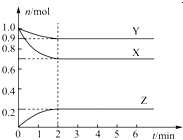
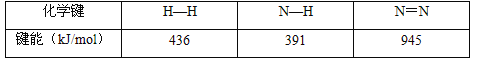
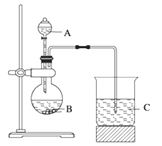
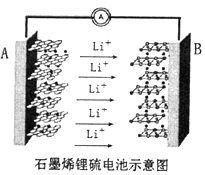
题目内容
【题目】下列关于普通玻璃的叙述中,正确的是( )
A. 它是人类最早使用的硅酸盐材料
B. 红色玻璃中含氧化亚铜
C. 它在加热熔化时有固定的熔点
D. 无色玻璃是纯净物
【答案】B
【解析】
A.陶瓷是人类最早使用的硅酸盐材料,故A错误;B.有色玻璃是在普通玻璃中加入某些金属氧化物制成的,如加入Cu2O烧成红色,故B正确;C.玻璃是混合物,没有固定的熔点,故C错误;D.无色玻璃的主要成分为硅酸钠、硅酸钙和二氧化硅,是混合物,故D错误;故选B。

 综合自测系列答案
综合自测系列答案【题目】某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如下:
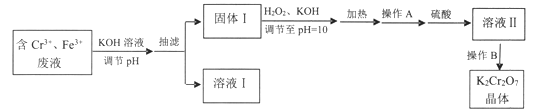
已知:
①Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
②金属离子沉淀的PH如下:
离子 | 开始沉淀的PH | 沉淀完全的PH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 4.1 |
③不同温度下化合物的溶解度如下:
物质 | 溶解度/(g/110g水) | ||
0℃ | 40℃ | 80℃ | |
K2SO4 | 7.4 | 14.8 | 21.4 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
请回答:
(1)操作A的名称是____,加入硫酸的目的是_____。
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式________。
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是__________。
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作__________。
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 24.98 |
2 | 25.00 | 1.56 | 29.30 |
3 | 25.00 | 1.00 | 26.02 |
则测得K2Cr2O7产品的纯度是_________(以质量分数表示)。