题目内容
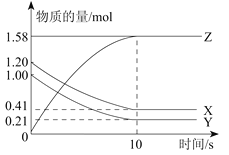
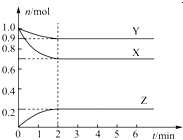
【题目】某温度下,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为____________。
(2)反应开始至2min,用气体Z表示的反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的____________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
【答案】(1)3X+Y![]() 2Z(2)0.05mol﹒L-1﹒min-1(3)①0.9 ②吸热
2Z(2)0.05mol﹒L-1﹒min-1(3)①0.9 ②吸热
【解析】
试题分析:(1)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,故答案为3X+Y![]() 2Z;
2Z;
(2)v(Z)=![]() =0.05molL-1min-1;
=0.05molL-1min-1;
(3)①根据图象中可知,开始时气体总物质的量为:2mol;平衡后气体总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol;![]() =0.9;
=0.9;
②压强变大,平衡向右移动,而体系温度降低,说明正反应方向为吸热。

练习册系列答案
相关题目
【题目】物质溶于水的过程中通常伴随着能量的变化,下表为四种物质的溶解热(“+”表示吸热,“-”表示放热)。
化学式 | NH4NO3 | NaOH | Ba(NO3)2 | KNO3 |
溶解热(kJ/mol) | +4.13 | -26.01 | + 1.57 | +3.49 |
将等物质的话的上述物质分别加入等质量的水中,所得溶液中水的离子积常数Kw最小的是
A. NH4NO3 B. NaOH C. KNO3 D. Ba(NO3)2