题目内容
某烃2.8g在氧气中燃烧生成8.8gCO2和3.6gH2O,在标准状况下其密度为2.5g/L,求其分子式.已知该烃可以使溴水褪色,写出符合要求的所有结构简式.
该烃在标准状况下其密度为2.5g/L,则其摩尔质量=2.5g/L×22.4L/mol=56g/mol,
2.8g该烃的物质的量=
=0.05mol,
8.8gCO2的物质的量=
=0.2mol,
3.6gH2O的物质的量=
=0.2mol,
故该烃分子中N(C)=
=4,N(H)=
=8,
故该烃的分子式C4H8,
该烃可以是溴水褪色,说明该烃中含有1个C=C双键,故该烃的结构简式有:
CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,
答:该有机物的分子式为C4H8;符合要求的所有结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2.
2.8g该烃的物质的量=
| 2.8g |
| 56g/mol |
8.8gCO2的物质的量=
| 8.8g |
| 44g/mol |
3.6gH2O的物质的量=
| 3.6g |
| 18g/mol |
故该烃分子中N(C)=
| 0.2mol×1 |
| 0.05mol |
| 0.2mol×2 |
| 0.05mol |
故该烃的分子式C4H8,
该烃可以是溴水褪色,说明该烃中含有1个C=C双键,故该烃的结构简式有:
CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,
答:该有机物的分子式为C4H8;符合要求的所有结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2.

练习册系列答案
相关题目
(15分)
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
操作 | 现象 |
|
|
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有 性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
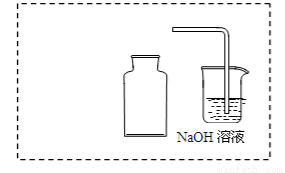
② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式 。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验 。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由 。
