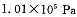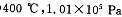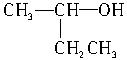题目内容
有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气).产物依次通过浓硫酸时,浓硫酸的质量增加了10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g.该有机物的化学式是( )
| A.C2H4 | B.C2H6O | C.C2H6O2 | D.C3H6O3 |
浓硫酸增重10.8g说明反应产物中含水10.8g,即产物中含水
=0.6mol,
通过灼热氧化铜,氧化铜质量减轻3.2g,物质的量为:
=0.2mol,
CO+CuO
CO2+Cu△m
1mol1mol 16g
0.2mol0.2mol 0.2mol
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g.
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为
=0.2mol,
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为2mol,
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为
=6mol,
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为
=1mol.
所以有机物的分子式为C2H6O,
故选B.
| 10.8g |
| 18g/mol |
通过灼热氧化铜,氧化铜质量减轻3.2g,物质的量为:
| 3.2g |
| 16g/mol |
CO+CuO
| ||
1mol1mol 16g
0.2mol0.2mol 0.2mol
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g.
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为
| 8.8g |
| 44g/mol |
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为2mol,
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为
| 0.6mol×2 |
| 0.2 |
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为
| 0.6mol+0.2mol+0.2mol×2-0.5mol×2 |
| 0.2 |
所以有机物的分子式为C2H6O,
故选B.

练习册系列答案
相关题目