题目内容
【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BC13的沸点为12.5 ℃ ,熔点为-107.3 ℃,遇水剧烈反应,生成硼酸和盐酸。该同学选用下图所示的部分装置(可以重复选用)进行实验,请回答下列问题:
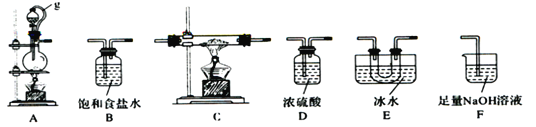
(1)A中反应的离子方程式为__________________。
(2)图中g管的作用是______________________________________。
(3)装置的连接顺序依次为A→ → → →E→D→F;____________在E、F装置间连接D装置的作用是____________________________________________________________。
(4)停止实验时,正确的实验操作是______________________________________________________________________________________________________________。
(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为_____(填“正盐”或“酸式盐”或“碱式盐”)。
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC1O、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红 溶液 | 现象 |
① | 5.0 | 0 | 0 | x | 4滴 | 较快褪色 |
② | 0 | 5.0 | 5.0 | 0 | 4滴 | 不褪色 |
③ | 5.0 | 0 | 5.0 | 0 | 4滴 | 缓慢褪色 |
则x=_______,结论:________________________________________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶 BDC 起干燥作用,防止三氯化硼遇水剧烈反应 先熄灭C处酒精灯,将F处导管拔出,最后熄灭A处酒精灯 正盐 5.0 NaClO能使品红溶液褪色,溶液碱性越强褪色越慢
Mn2++Cl2↑+2H2O 保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶 BDC 起干燥作用,防止三氯化硼遇水剧烈反应 先熄灭C处酒精灯,将F处导管拔出,最后熄灭A处酒精灯 正盐 5.0 NaClO能使品红溶液褪色,溶液碱性越强褪色越慢
【解析】(1)A中二氧化锰和浓盐酸发生氧化还原反应生成Cl2,离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(2)g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶;(3)A中二氧化锰和浓盐酸发生氧化还原反应生成Cl2,生成的Cl2中含有HCl、H2O,故连接B装置用饱和食盐水吸收氯化氢,再连接D装置浓硫酸吸水干燥,C中生成BCl3,用E得到BCl3固体,为防止生成的BCl3水解E装置之后需要干燥装置D,最后用F吸收未反应的Cl2;故答案为A→B→D→C→E→D→F;在E、F装置间连接D装置的作用是起干燥作用,防止三氯化硼遇水剧烈反应;(4)停止实验,先熄灭C处酒精灯,为防止倒吸,再拔F处导管,后熄灭A处酒精灯;(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为正盐;(6)向F中(溶液含有0.05mol/LNaC10、0.05mol/LNaCl、0.1mol/LN a0H)滴加品红溶液,发现溶液褪色.探究溶液褪色的原因,三组对比试验应溶液总体积相同,都为8mL溶液,故实验②氢氧化钠溶液为4.0mL,实验①③褪色,说明NaClO使品红溶液褪色,实验③褪色较慢,则溶液碱性越强褪色越慢。
Mn2++Cl2↑+2H2O;(2)g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶;(3)A中二氧化锰和浓盐酸发生氧化还原反应生成Cl2,生成的Cl2中含有HCl、H2O,故连接B装置用饱和食盐水吸收氯化氢,再连接D装置浓硫酸吸水干燥,C中生成BCl3,用E得到BCl3固体,为防止生成的BCl3水解E装置之后需要干燥装置D,最后用F吸收未反应的Cl2;故答案为A→B→D→C→E→D→F;在E、F装置间连接D装置的作用是起干燥作用,防止三氯化硼遇水剧烈反应;(4)停止实验,先熄灭C处酒精灯,为防止倒吸,再拔F处导管,后熄灭A处酒精灯;(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为正盐;(6)向F中(溶液含有0.05mol/LNaC10、0.05mol/LNaCl、0.1mol/LN a0H)滴加品红溶液,发现溶液褪色.探究溶液褪色的原因,三组对比试验应溶液总体积相同,都为8mL溶液,故实验②氢氧化钠溶液为4.0mL,实验①③褪色,说明NaClO使品红溶液褪色,实验③褪色较慢,则溶液碱性越强褪色越慢。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1mol H-H 键,1mol N-H键, 1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,且该反应为可逆反应,则N2与H2反应合成NH3的热化学方程式为_________。
(2)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应,
①下列描述能说明该可逆反应达到化学平衡状态的有___________
A.容器内气体的密度不变 B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.容器内的压强不变 D.3v正(H2) =2v逆(NH3)
E. 容器内气体的平均相对分子质量不变
F. 相同时间内有3molH-H键断裂,有6mol N-H键形成
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可以采用的方法有________________。
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=___________,该温度下反应的化学平衡常数数值为_________。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40 mol NO2,则达到平衡后: c(NO2)_____0.15 mol·L-1(填“>”、 “=”或“<”)
