题目内容
13.如表有关实验现象和解释或结论都正确的是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 确定碳酸氢钠固体中是否含有碳酸钠.把固体溶于水中,加入澄清石灰水 | 有白色沉淀生成 | 碳酸氢钠固体中含有碳酸钠 |
| C | 将NO2球浸泡在热水中 | 红棕色变浅 | 反应2NO2?N2O4的△H<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀变为黄色 | Ksp(AgI)<Ksp (AgCl) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫不能漂白指示剂;
B.氢氧化钙与碳酸钠、碳酸氢钠反应都生成碳酸钙沉淀;
C.二氧化氮为红棕色气体,现象与结论不一致;
D.发生沉淀的转化.
解答 解:A.二氧化硫与水反应生成亚硫酸,显酸性能够使石蕊变红,二氧化硫不能漂白指示剂,所以溶液只变红不褪色,故A错误;
B.氢氧化钙与碳酸钠、碳酸氢钠反应都生成碳酸钙沉淀,所以不能通过加入澄清石灰水检验碳酸氢钠固体中含有碳酸钠,故B错误;
C.二氧化氮为红棕色气体,将NO2球浸泡在热水中,若颜色加深,则反应2NO2?N2O4的△H<0,若颜色变浅,则反应2NO2?N2O4的△H>0,故C错误;
D.向AgCl沉淀中滴加KI溶液,白色沉淀转化为黄色沉淀,发生沉淀的转化,说明溶度积为AgI比AgCl更小,故D正确;
故选:D.
点评 本题考查化学实验方案的评价,涉及二氧化硫、碳酸盐的性质及化学平衡、沉淀转化,侧重物质性质及化学反应原理的考查,题目难度不大.

练习册系列答案
相关题目
3.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2H2O═2H2↑+O2↑ | D. | Na2O+H2O═2NaOH |
1.装置如图,通电后,发现Cu极附近溶液蓝色加深.下列说法正确的是( )
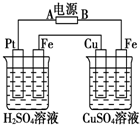

| A. | A极为负极,Cu为阳极 | |
| B. | 左烧杯溶液和右烧杯溶液的pH都变小 | |
| C. | 左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1 | |
| D. | 左烧杯溶液浓度变大,右烧杯溶液浓度不变 |
8.下列有关说法正确的是( )
| A. | 加热0.1mol/L Na2CO3溶液时,CO32-的水解程度和溶液的pH均增大 | |
| B. | 100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 | |
| C. | 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中C(CH3COO-)的值增大 |
5.下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al③Al(OH)3 ④Al2O3.
①NaHCO3②Al③Al(OH)3 ④Al2O3.
| A. | ②③ | B. | ③④ | C. | ②③④ | D. | ①②③④ |
2.下列说法正确的是( )
| A. | 摩尔是表示原子、分子、离子的物理量 | |
| B. | 摩尔质量就是相对分子质量 | |
| C. | 1mol任何粒子的粒子数叫做阿伏伽德罗常数,符号为NA | |
| D. | 物质的量就是物质的质量或数量 |
3. 如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
 如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )| A. | 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱 和石灰水温度升高,溶质析出 | |
| B. | 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出 | |
| C. | 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系 | |
| D. | 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量 |