��Ŀ����
����Ŀ��������ѧ֪ʶ�ش���������:
��1��A��NaOH��Һ��Ӧ��������ת����ϵ(����������ˮ������ʡ�ԣ�δ��ʾ����)��
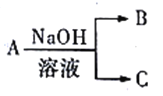
����AΪ�����������ʣ�CΪ���壬д����B��Һ��ͨ�����CO2��Ӧ�����ӷ���ʽ:_______________��
����AΪ�����ijɷ�֮һ�����������ЧӦ������100mL1mol/LNaOH��Һ��ͨ��1.344L����(��״����)��ַ�Ӧ������B��C�����ʵ���֮��Ϊ______(B��Ħ����������C)��
����AΪAlCl3��д��A��NaOH�����ʵ���֮��3:10���ʱ������Ӧ�����ӷ���ʽ:______________��
��2���Ȼ�����Һ�����ڸ�ʴӡˢͭ��·�壬��д����ص����ӷ���ʽ: ______________����μ�����Һ�е��������Ѿ���ȫ��Ӧ: ______________��
��3������AlCl3��FeCl3�����Һ,����A13+��Fe3+�����ʵ���֮��Ϊ0.1mol�������Һ�м���80mLŨ��Ϊ4mol/L��NaOH��Һ��ʹ���ַ�Ӧ����ԭ�����Һ��A13+�����ʵ�����A13+��Fe3+�������ʵ����ı�ֵΪx�����������ɵij�����ֻ��Fe(OH)3ʱ��x��ȡֵ��Χ��______������ͼ�л�����������(mol)��x(0��1.0)�仯������:______________
���𰸡� AlO2-+CO2+2H2O=HCO3-+Al(OH)3�� 2:1 3A13++10OH-=2Al(OH)3��+AlO2-+2H2O Cu+2Fe3+=2Fe2++Cu2+ ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ 0<x��0.2 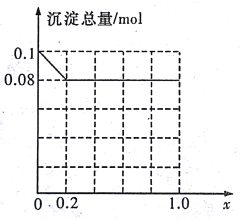
��������(1)����AΪ�����������ʣ���AΪ����CΪ���壬CΪ������BΪƫ�����ƣ���ƫ��������Һ��ͨ�����CO2��Ӧ������������������̼�����ƣ���Ӧ�����ӷ���ʽΪAlO2-+CO2+2H2O=HCO3-+Al(OH)3�����ʴ�Ϊ��AlO2-+CO2+2H2O=HCO3-+Al(OH)3����
����AΪ�����ijɷ�֮һ�����������ЧӦ����AΪ������̼��100mL1mol/LNaOH��Һ�к�����������0.1mol����״����1.344L������̼�����ʵ���Ϊ![]() =0.06mol���������ɵ�̼����Ϊxmol��̼������Ϊymol������̼ԭ���غ����ԭ���غ���x+y=0.06mol��2x+y=0.1mol�����x=0.04��y=0.02��B��Ħ����������C����BΪ̼���ƣ�CΪ̼�����ƣ�B��C�����ʵ���֮��=0.04mol��0.02mol=2:1���ʴ�Ϊ��2:1��
=0.06mol���������ɵ�̼����Ϊxmol��̼������Ϊymol������̼ԭ���غ����ԭ���غ���x+y=0.06mol��2x+y=0.1mol�����x=0.04��y=0.02��B��Ħ����������C����BΪ̼���ƣ�CΪ̼�����ƣ�B��C�����ʵ���֮��=0.04mol��0.02mol=2:1���ʴ�Ϊ��2:1��
����AΪAlCl3���Ȼ�������NaOH�����ʵ���֮��3:10���ʱ������������������ƫ�����ƣ���Ӧ�����ӷ���ʽΪ3A13++10OH-=2Al(OH)3��+AlO2-+2H2O���ʴ�Ϊ��3A13++10OH-=2Al(OH)3��+AlO2-+2H2O��
(2)�Ȼ�����ͭ����������ԭ��Ӧ�������Ȼ��������Ȼ�ͭ����Ӧ�����ӷ���ʽΪCu+2Fe3+=2Fe2++Cu2+��Ҫ֤����Һ�е��������Ѿ���ȫ��Ӧ��ֻ��Ҫ֤����Һ��û�������Ӽ��ɣ�������ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ���ʴ�Ϊ��Cu+2Fe3+=2Fe2++Cu2+��ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ��
(3)80mL 4mol/L��NaOH��Һ�к�����������0.32mol��Fe3+�����ʵ���Ϊ0.1mol��(1-x)�����ĵ�OH-���ʵ���Ϊ0.1mol��(1-x)��3��Fe3+��Ӧ��ʣ���OH-���ʵ���Ϊ0.32mol-0.1mol��(1-x)��3����������Al(OH)3����0.32mol-0.1mol��(1-x)��3��0.1mol��x��4�����x��0.2����0��x��0.2����0��x��0.2ʱ������ֻ��Fe(OH)3��Fe(OH)3������Ϊ0.1mol��(1-x)=0.1mol-0.1xmol��0.2��x��1ʱ����������Ϊ��0.1mol��(1-x)+0.1mol��x-(0.32mol-0.1mol��3)=0.08mol��
�ʳ�������(mol)��x(0��1.0)�仯������Ϊ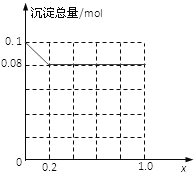 ���ʴ�Ϊ��0��x��0.2��
���ʴ�Ϊ��0��x��0.2�� ��
��

 �������ϵ�д�
�������ϵ�д�