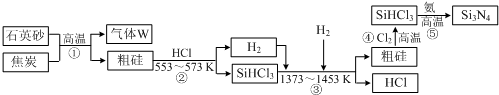
题目内容
15.写出2个电子层,且核外有10个电子组成的微粒的符号Ne、Na+、Mg2+、Al3+、N3-、O2-、F-等.分析 含有2个电子层,核外含有10个电子,可能为原子,如Ne,也可能为阳离子,如:钠离子、镁离子等,还可能为阴离子,如氧离子、氮离子等,据此写出满足条件的微粒符号.
解答 解:含有2个电子层,核外含有10个电子的原子为Ne;
含有2个电子层,核外含有10个电子的阳离子有:Na+、Mg2+、Al3+;
含有2个电子层,核外含有10个电子的阴离子有:N3-、O2-、F-,
故答案为:Ne、Na+、Mg2+、Al3+、N3-、O2-、F-等.
点评 本题考查原子结构、原子核外电子排布的应用,题目难度不大,明确原子结构与原子核外电子排布规律为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
5.人工光合系统装置(如图)可实现以CO2和H2O合成CH4.下列有关说法不正确的是( )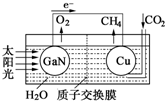

| A. | 该装置为原电池,且铜为正极 | |
| B. | 电池工作时,H+向Cu电极移动 | |
| C. | GaN电极表面的电极反应式为:2H2O-4e-═O2+4H+ | |
| D. | 反应CO2+2H2O═CH4+2O2中每消耗1mol CO2转移4mol e- |
6.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 大量排放氮氧化物可以形成酸雨、产生光化学烟雾,威胁人类生活环境 | |
| B. | 食用地沟油对人体危害大,但地沟油可用来制肥皂 | |
| C. | 明矾水解可生成Al(OH)3胶体,常用于水的杀菌消毒 | |
| D. | 人们可利用元素周期律在过渡元素中寻找性能优良的催化剂 |
3.下列说法正确的是( )
| A. | C60的摩尔质量是720 | |
| B. | 金刚石、石墨和C60互为同位素 | |
| C. | 因石墨具有导电性,可用石墨炸弹破坏输电线、电厂设备 | |
| D. | 在点燃的条件下,碳可以还原氧化镁生成镁和二氧化碳 |
20.300℃时,将100mL由H2O、CO2和N2组成的混合气体通入盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时容器内的压强变为原来的$\frac{4}{5}$.则原混合气体中N2的体积分数为( )
| A. | 33.3% | B. | 40% | C. | 60% | D. | 75% |
4.三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)

已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和气体;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)B中所装试剂是浓硫酸;
E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POC13、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.

已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和气体;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是浓硫酸;
E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POC13、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.
5.将下列物质的溶液滴在相应的试纸上,试纸变色情况符合实际的是( )
| A. | SO2(蓝色石蕊试纸先变红后褪色) | B. | 氯水(pH试纸先变红后褪色) | ||
| C. | Na2S(pH试纸变红) | D. | KI(淀粉试纸变蓝) |