题目内容
20.300℃时,将100mL由H2O、CO2和N2组成的混合气体通入盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时容器内的压强变为原来的$\frac{4}{5}$.则原混合气体中N2的体积分数为( )| A. | 33.3% | B. | 40% | C. | 60% | D. | 75% |
分析 Na2O2与CO2发生反应:2CO2+2Na2O2=2Na2CO3+O2,水蒸气与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2,减少体积为生成氧气体积,由方程式可知生成氧气体积为H2O、CO2总体积的一半,容器内的压强变为原来的$\frac{4}{5}$,则总体积减小原来的$\frac{1}{5}$,计算生成氧气的体积,进而计算H2O、CO2总体积,再计算氮气体积分数.
解答 解:容器内的压强变为原来的$\frac{4}{5}$,则总体积减小原来的$\frac{1}{5}$,故反应后总体积减少为100mL×$\frac{1}{5}$=20mL,
Na2O2与CO2发生反应:2CO2+2Na2O2=2Na2CO3+O2,水蒸气与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2,减少的体积=生成氧气的体积,由方程式可知生成氧气体积为H2O、CO2总体积的一半,则H2O、CO2总体积为:20mL×2=40mL,
故原混合气体中氮气为:100mL-40mL=60mL,
则氮气体积分数为:$\frac{60mL}{100mL}$×100%=60%,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,明确差量法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.1L 1mol•L-1 Na2SO4溶液中,下列各量正确的是( )
| A. | c(Na+)=1mol•L-1 | B. | n(Na+)=3mol | C. | c(SO42-)=2mol•L-1 | D. | m(Na2SO4)=142g |
9.下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
| A. | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 说明原溶液中一定含有FeCl3 | |
| B. | H3PO3+2NaOH(足量)=Na2HPO3+2H2O,H3PO3属于三元酸 | |
| C. | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀酸雨中一定含有SO42- | |
| D. | CaO$\stackrel{H_2{O}}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH 用生石灰制备NaOH溶液 |
10.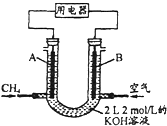 碳及其含碳化合物在人们的生产生活中应用广泛.
碳及其含碳化合物在人们的生产生活中应用广泛.
(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),得到如表三组数据;
①实验1中以v(H2)表示的反应速率为0.4mol/(L.min)
②900℃化学平衡常数为0.12,第3组与第2组相比CO2的转化率增大(填“增大”“减小”“不变”不能确定).
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-
③V=67.2L时,溶液中离子浓度大小关系为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 碳及其含碳化合物在人们的生产生活中应用广泛.
碳及其含碳化合物在人们的生产生活中应用广泛.(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),得到如表三组数据;
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO2 | H2 | H2 | C2H5OH | |||
| 1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
| 2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
| 3 | 900 | 4 | 8.8 | C | d | t |
②900℃化学平衡常数为0.12,第3组与第2组相比CO2的转化率增大(填“增大”“减小”“不变”不能确定).
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-
③V=67.2L时,溶液中离子浓度大小关系为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).