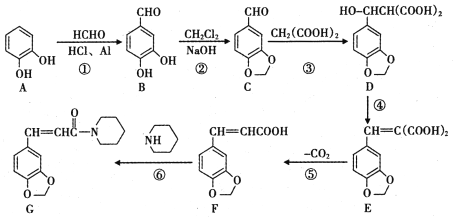
题目内容
【题目】某工厂用硝酸为原料生产亚硝酸钠的工艺流程如下,等物质的量的NO和NO2恰好能被Na2CO3溶液在吸收塔中完全吸收生成NaNO2。
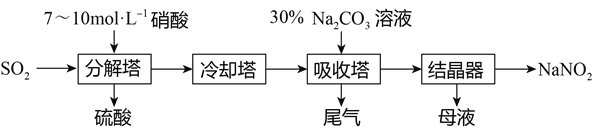
(1)吸收塔中发生反应的化学方程式是____________________。
(2)分解塔中需要严格控制硝酸的浓度,目的是______________________________。
(3)向母液中加入硝酸,发生反应3NaNO2+2HNO3=3NaNO3+2NO↑+H2O,经结晶可制得副产品NaNO3。对该过程中产生的NO的处理方法是________________________________________。
【答案】 NO+NO2+Na2CO3=2NaNO2+CO2 控制产物中NO和NO2的比例,使其完全转化为NaNO2 通入至分解塔中,循环使用。
【解析】(1)一氧化氮和二氧化氮被碳酸钠溶液吸收,反应的方程式为NO+NO2+Na2CO3=2NaNO2+CO2↑;
(2)分解塔中需要严格控制硝酸的浓度,是使二氧化硫与硝酸反应产生一氧化氮和二氧化氮的量之比为1:1,便于的吸收塔中恰好转化为亚硝酸盐,所以目的是控制产物中NO和NO2的比例;
(3)反应产生的一氧化氮可通过氧化,将部分转化为二氧化氮,然后通入吸收塔中循环利用。

练习册系列答案
相关题目