题目内容
【题目】氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
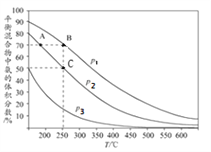
①由图可知:p1、p2、p3的大小关系为________,理由是_____________________________
②A、B点生成氨气的速率大小关系为_____________,C点,N2的转化率为_____。
③下列关于合成氨的说法正确是_________ (填序号)。
A.断开1个N≡N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,写出负极的电极反应式:__________________
【答案】 p1>p2>p3 相同温度下,p1到p3氨的体积分数降低,说明平衡左移,压强减小 vA<vB 66.7% BD 2NH3-6e-+6OH-==N2+6H2O
【解析】I.①由图可知:p1、p2、p3的大小关系为p1>p2>p3,理由是相同温度下,p1到p3氨的体积分数降低,说明平衡左移,压强减小。
②A、B两点中,A点对应的反应温度和压强均比B点小,所以A、B点生成氨气的速率大小关系为vA<vB。设C点对应N2的转化率为![]() ,由图可知C点对应氨的体积分数为50%,则
,由图可知C点对应氨的体积分数为50%,则![]() ,解之得N2的转化率
,解之得N2的转化率![]() 为66.7% 。
为66.7% 。
③A.断开1个N≡N键的同时有6个N—H键形成,都表示正反应速率,不能说明正反应速率和逆反应速率相等,所以反应不一定达到平衡状态,A不正确;B.该反应的正反应方向是气体分子数减小的方向,所以反应过程中混合气体的平均相对分子质量逐渐增大,当混合气体的平均相对分子质量不再改变状态时,反应一定达到平衡状态,B正确;C. 合成氨反应△H<0、△S<0,由综合判剧△H-T△S<0时反应能自发进行,所以合成氨反应在低温下能自发进行,在高温下氨易分解,C不正确;D.增大n(N2):n(H2)的比值,有利用提离H2的转化率,D正确。综上所述,关于合成氨的说法正确是BD 。
II.电池反应为4NH3+3O2==2N2+6H2O,正极的电极反应为O2+4e-+2H2O=4OH-,所以负极的电极反应式为2NH3-6e-+6OH-==N2+6H2O .

 高中必刷题系列答案
高中必刷题系列答案