题目内容
2.(1)用实验方法探究钠、镁、铝的金属性强弱.(2)列举化学事实说明Si、P、S的非金属性强弱.
分析 (1)Na与冷水剧烈反应,Mg与热水才反应,Al与热水也不反应;
(2)最高价氧化物的水化物的酸性越强,则元素的非金属性越强.
解答 解:(1)在盛有冷水的烧杯中加几滴酚酞,然后加入一小块钠,Na与冷水剧烈反应,溶液变红色;在盛有冷水的烧杯中加几滴酚酞,再加入镁条,无明显现象,加热,Mg与水反应,溶液变红色;在盛有冷水的烧杯中加几滴酚酞,再加入铝片,无明显现象,加热,无现象;金属性越强,金属与水反应越剧烈,所以金属性Na>Mg>Al;
答:在盛有冷水的烧杯中加几滴酚酞,然后加入一小块钠,Na与冷水剧烈反应,溶液变红色;在盛有冷水的烧杯中加几滴酚酞,再加入镁条,无明显现象,加热,Mg与水反应,溶液变红色;在盛有冷水的烧杯中加几滴酚酞,再加入铝片,无明显现象,加热,无明显现象;
(2)最高价氧化物的水化物的酸性越强,则元素的非金属性越强,相同条件下,硅酸为弱酸、磷酸为中强酸、硫酸为强酸,所以非金属性:Si<P<S,
故答案为:硅酸为弱酸、磷酸为中强酸、硫酸为强酸,所以非金属性:Si<P<S.
点评 本题考查了金属性与非金属性强弱的判断,题目难度不大,侧重于考查学生的实验设计能力.

练习册系列答案
相关题目
12.如图是一个化学反应的微观示意图,从示意图获取的信息正确的是( )
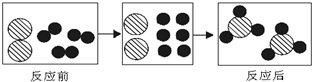

| A. | 反应前后分子种类不发生改变 | |
| B. | 反应前后原子的种类与数目发生改变 | |
| C. | 反应前两种分子的个数比是1:2 | |
| D. | 该反应的基本类型是化合反应 |
10.实验室用固体氯化钠配制500mL 0.2mol•L-1的NaCl溶液,下列仪器用不到的是( )
| A. | 500 mL容量瓶 | B. | 胶头滴管 | C. | 分液漏斗 | D. | 烧杯 |
17.把ag铜铁合金粉末投入足量盐酸中,反应完全后过滤.向滤液中加入过量氢氧化钠溶液,过滤,沉淀经洗涤.干燥.灼烧,得到红棕色粉末的质量仍为ag,则此合金中铜的质量分数为( )
| A. | 70% | B. | 30% | C. | 52.4% | D. | 22.2% |
14.下列依据相关实验得出的结论正确的是( )
| A. | 在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| B. | 测得Na2CO3溶液的pH大于同浓度的Na2SO3溶液,说明非金属性C<S | |
| C. | 用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液 | |
| D. | 在淀粉溶液中加入稀硫酸并加热片刻再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
12.与50mL 0.1mol/L Na2CO3溶液中Na+的物质量浓度相同的溶液是( )
| A. | 50 mL 0.1 mol/L的NaCl溶液 | B. | 100 mL 0.2 mol/L的NaCl溶液 | ||
| C. | 25 mL 0.2 mol/L的Na2SO4溶液 | D. | 10 mL 0.5 mol/L的Na2CO3溶液 |

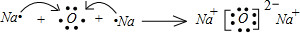 .
.