题目内容
8.以下说法错误的是( )| A. | 银氨溶液可用于区分麦芽糖和葡萄糖 | |
| B. | 乙烷、乙醛、乙酸的沸点逐渐升高 | |
| C. | 1mol乙酰水杨酸(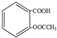 )最多可以和3molNaOH反应 )最多可以和3molNaOH反应 | |
| D. | 邻甲基苯酚(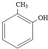 )可以和HCHO发生缩聚反应 )可以和HCHO发生缩聚反应 |
分析 A.麦芽糖和葡萄糖中都含有醛基,都能发生银镜反应;
B.分子晶体的熔沸点与其相对分子质量成正比;
C.羧基、酯基水解生成的酚羟基和羧基都能和NaOH反应;
D.邻甲基苯酚和甲醛能发生缩聚反应生成高分子化合物.
解答 解:A.麦芽糖和葡萄糖中都含有醛基,都能发生银镜反应,所以不能用银氨溶液鉴别麦芽糖和葡萄糖,故A错误;
B.分子晶体的熔沸点与其相对分子质量成正比,乙烷、乙醛、乙酸的相对分子质量逐渐增大,所以其沸点逐渐升高,故B正确;
C.羧基、酯基水解生成的酚羟基和羧基都能和NaOH反应,所以1mol乙酰水杨酸( )最多可以和3molNaOH反应,故C正确;
)最多可以和3molNaOH反应,故C正确;
D.苯酚能和甲醛在一定条件下发生缩聚反应生成酚醛树脂,邻甲基苯酚中含有酚羟基,所以邻甲基苯酚和甲醛能发生缩聚反应生成高分子化合物,故D正确;
故选A.
点评 本题考查有机物鉴别、分子晶体熔沸点比较、有机物的结构和性质等知识点,明确有机物中官能团及其性质关系是解本题关键,易错选项是C,注意乙酰水杨酸水解生成的酚羟基能和NaOH反应.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
11.已知Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+.下列有关说法正确的是( )
| A. | 当c(Cu2+)=c(Mn2+)时该反应达到平衡 | |
| B. | 从该反应原理可以得出CuS的溶解度比MnS的溶解度大 | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ | |
| D. | 往平衡体系中加入少量CuSO4(s)后,c( Mn2+)不变 |
16.下列表示的是有机化合物结构式中的一部分,其中不是官能团的是( )
| A. | -OH | B. | -C≡C- | C. |  | D. | C-C |
3.下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | HCl | ClO-+H+=HClO |
| C | Ba2+、Al3+、Cl-、H+ | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | S2O32-、Na+、Cl-、SO32-、K+ | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
20.短周期元素A、B、C、D、E是同周期的五种元素,A和B的最高价氧化物对应水化物呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D,五种元素形成的简单离子中E的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A. | C、D、E、A、B | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | B、A、E、D、C |
17.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”.下列有关“四中子”粒子的说法不正确的是( )
| A. | 该粒子不显电性 | B. | 该粒子质量数为4 | ||
| C. | 与氢元素的质子数相同 | D. | 该粒子质量比氢原子大 |
18.某烃结构简式如图: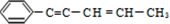 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
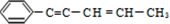 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有原子不可能在同一条直线上 | ||
| C. | 所有碳原子可能在同一平面上 | D. | 该烃属于苯的同系物 |