题目内容
【题目】用双线桥标出下列反应电子转移的方向和数目,并指出氧化剂、还原剂和氧化产物、还原产物。
①2KMnO4 + 16HCl=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O_________。
氧化剂(___________)、还原剂(___________)、氧化产物(____________)、还原产物(____________)。
②H2S + H2SO4=S↓+ SO2↑+ 2H2O_______________。
氧化剂(___________)、还原剂(___________)、氧化产物(____________)、还原产物(____________)。
【答案】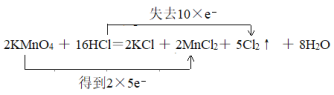 KMnO4 HCl Cl2 MnCl2
KMnO4 HCl Cl2 MnCl2 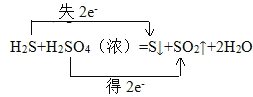 H2SO4 H2S S SO2
H2SO4 H2S S SO2
【解析】
根据得失电子判断氧化剂、还原剂;根据氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物判断;氧化剂、还原剂得失电子相等的数值为转移电子数。
①反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中锰元素的化合价由+7价变成+2价,盐酸中部分氯由-1价变成0价,双线桥法标出电子转移的方向和数目为 ,其中氧化剂为KMnO4、还原剂为HCl、氧化产物为Cl2,还原产物为MnCl2;
,其中氧化剂为KMnO4、还原剂为HCl、氧化产物为Cl2,还原产物为MnCl2;
②方程式H2S+H2SO4(浓)=S↓+SO2↑+2H2O中化合价的变化为:H2S→S,S元素由-2价→0价,一个H2S分子失去2个电子,则H2S是还原剂;S是氧化产物;H2SO4→SO2,S元素由+6价→+4价,一个H2SO4分子得2个电子,所以H2SO4是氧化剂,SO2是还原产物;得失电子的最小公倍数是2,转移电子数为2,用双线桥分析为 。
。

练习册系列答案
相关题目