题目内容
【题目】镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是__________________。
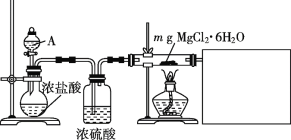
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

该工艺中可循环使用的物质有______________。
(3)储氢材料Mg(AlH4)2在110~200 ℃的反应为Mg(AlH4)2=MgH2+2Al+3H2↑,每转移6 mol电子生成氢气的物质的量为________mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.100 0 g产品用适量硝酸溶解,经稀释等步骤最终配得500 mL的溶液。
a.准确量取25.00 mL 待测液,用0.100 0 mol/L AgNO3标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为________mL。

b.
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
参照上表数据及信息分析,滴定时可以作指示剂的是________(填数字序号)。
①CaCl2 ②NaBr ③NaI ④K2CrO4
【答案】第三周期第ⅡA族 HCl、Cl2 3 16.00 ④
【解析】
(1)镁为12号元素,核外含有3个电子层,最外层含有2个电子,据此可知Mg在周期表中位置;
(2)①电解无水氯化镁反应产生Mg与Cl2,H2与Cl2点燃生成HCl,氯化镁晶体在HCl的气流中加热制取无水氯化镁,据此分析;
(3)H元素的化合价在储氢材料Mg(AlH4)2中为-1价,反应后变为H2的0价,据此分析解答;在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,该反应中生成3molH2转移电子6mol;
(4) a.滴定前滴定管中读数为2.50mL,滴定后读数为18.50mL,据此可知消耗硝酸银标准液的体积;
b滴定实验是利用沉淀变色指示反应沉淀完全,在氯化银刚好沉淀完成,再滴加硝酸银溶液,与指示剂作用生成不同现象来进行判断;本题应在Ag+和Cl-生成AgCl沉淀后,再生成不同颜色沉淀指示沉淀终点。则指示剂的溶解度应比AgCl大来分析判断。
(1)镁为12号元素,在元素周期表中位于第三周期第ⅡA族;
(2)循环使用的物质是加入后在反应过程中又重新生成的物质。加热氯化镁晶体制取无水氯化镁,为防止Mg2+水解,要在HCl的气流中加热,制取得到的无水氯化镁电解产生镁和氯气,氯气与氢气在点燃时反应得到HCl气体,可见在该流程中循环利用的为HCl、Cl2;
(3)储氢材料在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,根据方程式可知:H元素的化合价在储氢材料Mg(AlH4)2中为-1价,反应后变为H2的0价,反应中生成3molH2转移电子6mol;
(4) a.根据滴定前后滴定管中的液面读数可知硝酸银标准液的体积为:V=18.50mL-2.50mL=16.00mL;
b.氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为AgCl>AgBr>AgI;随Ksp的减小,应先出现AgI沉淀、再出现AgBr,最后才沉淀AgCl;所以不符合滴定实验的目的和作用;铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=c(Ag+)c(Cl-)=2×10-10,Ksp(Ag2CrO4)=c(Ag+)2c(CrO42-)=2.0×10-12,c(Cl-)=![]() mol/L;c(CrO42-)=
mol/L;c(CrO42-)=![]() mol/L>
mol/L>![]() mol/L=c(Cl-),可见同浓度的银离子需要的氯离子浓度小于CrO42-浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,可以作指示剂可以正确的测定氯化物的含量,故④合理。
mol/L=c(Cl-),可见同浓度的银离子需要的氯离子浓度小于CrO42-浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,可以作指示剂可以正确的测定氯化物的含量,故④合理。

【题目】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) | H2NCOONH4(l)
|
快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:____________________________,该反应热为![]() ,则
,则![]() ______________(“大于”“小于”或“等于”)
______________(“大于”“小于”或“等于”)![]() 。
。
(2)下列说法正确的是________________。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比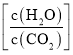 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为![]() 时(
时(![]() ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比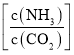 的变化如表所示:
的变化如表所示:
氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________.
(4)一定条件下,在图中绘制氨基甲酸铵(![]() )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
 _______________
_______________
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________.