题目内容
【题目】下列叙述中正确的是( )
A.可用明矾和漂白粉处理自来水,二者的作用原理相同
B.室温下向10mLpH=3的醋酸溶液中加水稀释后,溶液中![]() 不变
不变
C.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
D.可用澄清的石灰水鉴别碳酸钠和碳酸氢钠
【答案】B
【解析】
![]() 明矾水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中悬浮物来净水;漂白粉中次氯酸钠具有强氧化性,能使病毒被氧化而能杀菌消毒,二者原理不同,故A错误;
明矾水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中悬浮物来净水;漂白粉中次氯酸钠具有强氧化性,能使病毒被氧化而能杀菌消毒,二者原理不同,故A错误;
B.醋酸是弱电解质,加水稀释促进醋酸电离,溶液中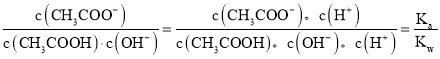 ,平衡常数只与温度有关,所以溶液中
,平衡常数只与温度有关,所以溶液中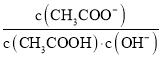 不变,故B正确;
不变,故B正确;
C.氯水是氯气的水溶液,氨水是氨气的水溶液,王水是浓硝酸和浓盐酸的混合物,水银为Hg,水玻璃是硅酸钠的水溶液,所以氯水、氨水、王水、水玻璃都是混合物,只有水银是纯净物,故C错误;
D.碳酸钠和碳酸氢钠都与澄清石灰水反应生成白色沉淀,所以不能用澄清石灰水鉴别碳酸钠和碳酸氢钠,可以用![]() 溶液鉴别,故D错误;
溶液鉴别,故D错误;
故选:B。

 阶梯计算系列答案
阶梯计算系列答案【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1 盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______,______。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?__________。
(3)他们记录的实验数据如下:已知:![]()
①计算完成下表。(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 温度差平均值 | ||
t 1 | t 2 | ||||
1 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.3℃ | _____ |
2 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.5℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:______________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将________(填“变大”或“变小”或“无影响”)。
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
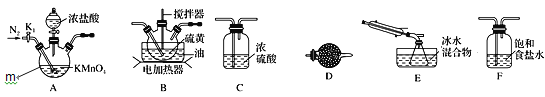
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
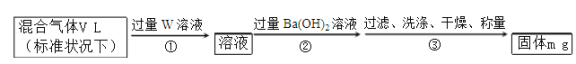
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。