题目内容
【题目】I.已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]()
![]()
![]() ③
③
![]()
![]()
![]() ④
④
请回答下列问题
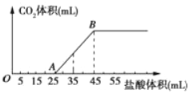
(1)若反应②生成标准状况下的33.6LN2O,则转移电子数为______ 。
(2)反应③中物质X的化学式是 _______________。
(3)反应④中氧化产物是 ___________。(填化学式)
II.某同学写出以下三个化学方程式(未配平):
①NO+HNO2→N2O3+H2O ②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2 其中你认为有可能实现的是_________________。
III.下列三个氧化还原反应中,氧化剂氧化性由强到弱的顺序是_________________。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
【答案】6NA H2O N2 ③ KMnO4>Cl2>FeCl3>I2
【解析】
I.(1)根据化合价的变化计算转移的电子;
(2)利用原子守恒判断X的化学式;
(3)得电子被还原,得到还原产物,失电子被氧化,得到氧化产物;
II.依据氧化还原反应化合价变化规律,如果发生氧化还原反应,则一定有元素化合价升降,据此分析解答;
III.根据氧化剂的氧化性强于氧化产物的氧化性分析解答。
I.(1)若反应②生成标准状况下的33.6LN2O,物质的量是33.6L÷22.4L/mol=1.5mol,铵根中氮元素从-3价升高到+1价,硝酸根中氮元素从+5价降低到+1价,转移4个电子,则转移电子的物质的量是6mol,电子数为6NA。
(2)根据原子守恒可知反应③中物质X的化学式是H2O。
(3)铵根中氮元素从-3价升高到0价,失去电子被氧化,硝酸根中氮元素从+5价降低到+4价,得到电子被还原,则反应④中氧化产物是N2。
II.①NO+HNO2→N2O3+H2O:NO中氮元素化合价从+2价升高到+3价,而亚硝酸中氮元素化合价不变,不符合氧化还原反应规律,不能发生;
②NH3+NO→HNO2+H2O:氨气中氮元素从-3价升高到+3价,NO中氮元素化合价从+2价升高到+3价,没有化合价降低,不符合氧化还原反应规律,不能发生;
③N2O4+H2O→HNO3+HNO2:四氧化二氮中氮元素从+4价部分降低到+2价,部分升高到+5价,符合氧化还原反应规律,可以发生,答案选③。
III.①2FeCl3+2KI=2FeCl2+2KCl+I2中氧化剂是氯化铁,氧化产物是碘,则氧化性FeCl3>I2;
②2FeCl2+Cl2=2FeCl3中氧化剂是氯气,氧化产物是氯化铁,则氧化性Cl2>FeCl3;
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中氧化剂是高锰酸钾,氧化产物是氯气,则氧化性KMnO4>Cl2;
综上所述氧化剂氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3>I2。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案