题目内容
(3分)氨的催化氧化是工业上制硝酸的基础:4NH3+xO2 4NO+6H2O。该化学方程式中x的数值是 ,其中作为还原剂的物质是 (填化学式);若反应中生成了4 mol NO,则需消耗 mol NH3。
4NO+6H2O。该化学方程式中x的数值是 ,其中作为还原剂的物质是 (填化学式);若反应中生成了4 mol NO,则需消耗 mol NH3。
 4NO+6H2O。该化学方程式中x的数值是 ,其中作为还原剂的物质是 (填化学式);若反应中生成了4 mol NO,则需消耗 mol NH3。
4NO+6H2O。该化学方程式中x的数值是 ,其中作为还原剂的物质是 (填化学式);若反应中生成了4 mol NO,则需消耗 mol NH3。5 NH3 4
略

练习册系列答案
相关题目
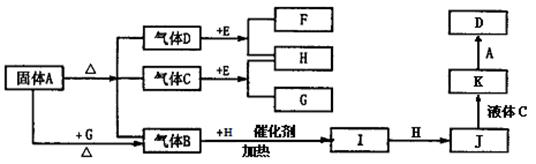

 N2O4)
N2O4)