题目内容
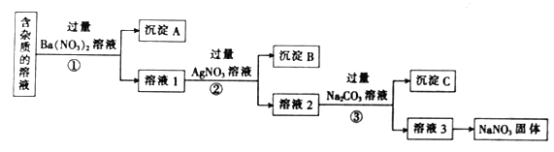
【题目】电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
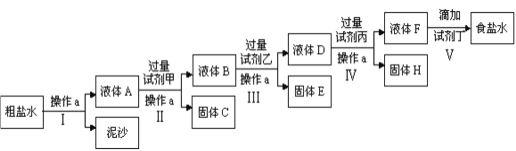
请回答以下问题:
(1)操作a的名称是_______,所用玻璃仪器有____________________________________。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为_____________溶液(写化学式);在III步中,判断试剂乙已加入过量的方法是:_______________。
(3)固体H所含物质的化学式为_________________________________________。
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,此过程中发生反应的离子方程式为______________________。
【答案】 过滤 漏斗、烧杯、玻璃棒 NaOH 取少量上层澄清液于试管中,继续加试剂乙,无现象,则试剂乙已过量 CaCO3 BaCO3 H++OH-===H2O CO![]() +2H+===H2O+CO2↑
+2H+===H2O+CO2↑
【解析】试题分析:粗盐的精制流程是操作Ⅰ通过过滤除去不溶性杂质,得到的溶液中含有杂质离子Ca2+、Mg2+、Fe3+、SO42-,加入过量试剂甲生成了两种大量的难溶沉淀,为氢氧化钠沉淀铁离子和镁离子,所以甲是氢氧化钠,过滤得到溶液中含有Ca2+、OH-、SO42-杂质,加入过量试剂乙为氯化钡沉淀硫酸根离子,过滤得到的溶液中含有OH-、Ca2+、Ba2+,加入过量碳酸钠溶液,除去Ca2+、Ba2+,过滤得到溶液中含有氢氧根离子、碳酸根离子,加入适量盐酸到不再有气体产生得到食盐水;
解析:根据以上分析,(1)操作a是通过过滤除去不溶性杂质的操作,实现固体和溶液分离的方法是过滤,所用的玻璃仪器为漏斗、玻璃棒、烧杯;(2)粗盐中含有Ca2+、Mg2+、Fe3+、SO42-,加入过量试剂氢氧化钠后,可以将镁离子以及铁离子沉淀,试剂甲为NaOH溶液;(3)试剂乙是氯化钡,通过检验溶液中是否含有SO42-判断氯化钡是否过量,方法是取少量上层澄清液于试管中,继续加试剂乙,无现象,则试剂乙已过量;(3)固体H的成分为CaCO3和BaCO3;(4)操作V为加盐酸除去过量的氢氧根和碳酸根,反应的离子方程式为H++OH–=H2O;2H++ CO32–= CO2↑ + H2O。