题目内容
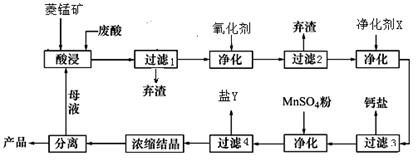
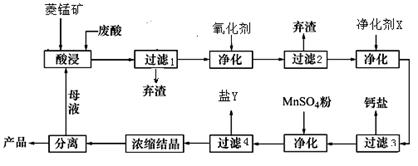
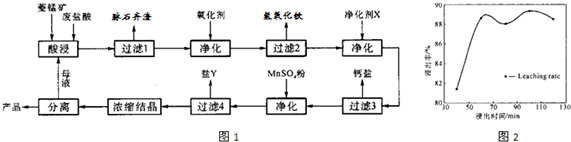
菱锰矿的主要成分是碳酸锰,还含有Fe2O3、FeO、CaO、MgO等成分.某化工厂用废盐酸(质量分数约为20%)与菱锰矿制备MnCl2.4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水),部分工艺流程如图1:
(1)盐酸与菱锰矿中碳酸锰反应的化学方程式为
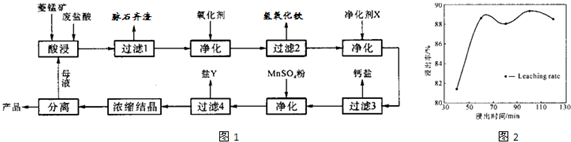
(2)酸浸取时,浸出时间对浸出率的影响如图2所示,工业采用的浸取时间是60min,其可能的原因是
(3)图1中“净化剂X”可能是
(4)加入MnSO4后控制实验条件析出某种杂质离子的盐Y,盐Y的主要成分是
(5)浓缩结晶时,必须一出现晶膜就立刻停止加热,其原因是

(1)盐酸与菱锰矿中碳酸锰反应的化学方程式为
MnCO3+2HCl=MnCl2+CO2↑+H2O
MnCO3+2HCl=MnCl2+CO2↑+H2O
(2)酸浸取时,浸出时间对浸出率的影响如图2所示,工业采用的浸取时间是60min,其可能的原因是
浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理
浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理
.(3)图1中“净化剂X”可能是
MnCO3
MnCO3
.(4)加入MnSO4后控制实验条件析出某种杂质离子的盐Y,盐Y的主要成分是
MgSO4
MgSO4
.(5)浓缩结晶时,必须一出现晶膜就立刻停止加热,其原因是
若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯
若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯
.分析:(1)菱锰矿的主要成分是碳酸锰,碳酸锰与盐酸反应符合复分解反应,生成氯化锰、二氧化碳、水.
(2)图中反映浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.再延长浸出时,浸出的增量不明显,而且还会增大生产成本.
(3)由工艺流程可知,图1中“净化剂X”目的除去溶液中Ca2+,因为不能引入新的杂质,所以“净化剂X”是MnCO3.
(4)根据转化图可知,此时留在溶液中的阳离子除了锰离子外,主要就是镁离子.据此判断.
(5)由信息可知,MnCl2?4H2O在加热时容易失去结晶水,导致产品不纯.
(2)图中反映浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.再延长浸出时,浸出的增量不明显,而且还会增大生产成本.
(3)由工艺流程可知,图1中“净化剂X”目的除去溶液中Ca2+,因为不能引入新的杂质,所以“净化剂X”是MnCO3.
(4)根据转化图可知,此时留在溶液中的阳离子除了锰离子外,主要就是镁离子.据此判断.
(5)由信息可知,MnCl2?4H2O在加热时容易失去结晶水,导致产品不纯.
解答:解:1)菱锰矿的主要成分是碳酸锰,碳酸锰与盐酸反应生成氯化锰、二氧化碳、水,反应方程式为MnCO3+2HCl=MnCl2+CO2↑+H2O.
故答案为:MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)图中反映浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理.
故答案为:浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理.
(3)由工艺流程可知,图1中“净化剂X”目的除去溶液中Ca2+,因为不能引入新的杂质,所以“净化剂X”是MnCO3.
故答案为:MnCO3.
(4)根据转化图可知,此时留在溶液中的阳离子除了锰离子外,主要就是镁离子,所以Y是硫酸镁晶体.
故答案为:MgSO4.
(5)由信息可知,MnCl2?4H2O在加热时容易失去结晶水,若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯.
故答案为:若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯.
故答案为:MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)图中反映浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理.
故答案为:浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理.
(3)由工艺流程可知,图1中“净化剂X”目的除去溶液中Ca2+,因为不能引入新的杂质,所以“净化剂X”是MnCO3.
故答案为:MnCO3.
(4)根据转化图可知,此时留在溶液中的阳离子除了锰离子外,主要就是镁离子,所以Y是硫酸镁晶体.
故答案为:MgSO4.
(5)由信息可知,MnCl2?4H2O在加热时容易失去结晶水,若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯.
故答案为:若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯.
点评:考查学生对工艺流程的理解、阅读题目获取信息的能力、对实验操作的理解、物质分离提纯等,难度中等,需要学生综合运用知识解决问题,注意基础知识的全面掌握.

练习册系列答案
相关题目