题目内容
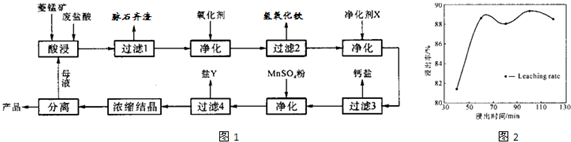
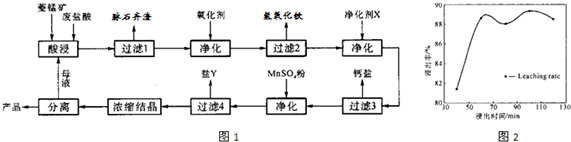
(12分)菱锰矿的主要成分是碳酸锰,还含 Fe2O3、FeO 、CaO、MgO 等成分。某化工厂用废盐酸(质量分数约20%)与菱锰矿制备MnCl2·4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水而成无水物),部分工艺流程如下:
(1)废盐酸与菱镁矿中碳酸锰反应的化学方程式为:_______________________________。
(2)酸浸时,浸出时间对锰浸出率的影响如右图,工业采用的是浸取60min,其可能原因是:____________________________________________________。
(3)图中“净化剂X”可能是________________________。
(4)过滤4获得的盐Y,其主要成分是__________________________。
(5)浓缩结晶时,必须一出现晶膜立刻停止加热,其原因是:_______________________。
(1)MnCO3+2HCl=MnCl2+CO2↑+H2O(3分)
(2)60min后,再延长浸出时,增大生产成本,而浸出的增量不明显。(3分)
(3)MnCO3(2分)
(4)硫酸镁(MgSO4·7H2O)(2分)
(5)水份很少时,最终得到的可能是失去部分结晶水的氯化锰。(2分)
解析:(1)碳酸锰和盐酸反应的生成物氯化锰、水和CO2,化学方程式为
MnCO3+2HCl=MnCl2+CO2↑+H2O。
(2)根据图像可知)60min后,再延长浸出时,浸出的增量不明显,而且还会增大生产成本。
(3)因为不能引入新的杂质,所以“净化剂X”是MnCO3。
(4)根据转化图可知,此时留在溶液中的阳离子除了锰离子外,主要就是镁离子,所以Y是硫酸镁。
(5)MnCl2·4H2O在加热时容易失去结晶水,导致产品不纯。

 阅读快车系列答案
阅读快车系列答案