题目内容
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.Fe3+开始沉淀为氢氧化物的PH=1,沉淀完全时的PH为3.7.
I.某探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:
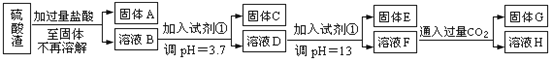
请回答:
(1)写出固体E的化学式:______________.试剂①是__________(填选项字母).
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是__________(填选项字母).
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:______________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________________.
方案二:
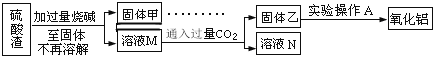
(5)此方案制得的氧化铝含有的主要杂质是_________________。
(6)写出由溶液M→固体乙这个过程中,主要化学反应的离子方程式:_______________;_______________。
(7)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:_______________。
(8)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2molL-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是_____________.
【答案】
(1)Mg(OH)2:A;(2)C;
(3)NaCl、NaHCO3;(4)灼烧;(5)二氧化硅;
(6)SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(7)MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;(8)5.6%。
【解析】
试题分析:(1)根据以上分析,固体E是氢氧化镁,试剂①是强碱溶液,故答案为:Mg(OH)2:A;
(2)因pH值精确到小数点后一位,而石蕊试液测得的PH值在一个范围内,广泛pH试纸测得的pH值是一个整数,精密pH试纸、pH计均可准确到小数点后一位,故选:C;
(3)溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,所以溶液H的溶质含有NaCl 和 NaHCO3,故答案为:NaCl、NaHCO3;
(4)固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,故答案为:灼烧;
(5)根据以上分析,固体乙是硅酸、氢氧化铝,进行加热得到二氧化硅和氧化铝,所以此方案制得的氧化铝含有的主要杂质是二氧化硅,故答案为:二氧化硅;
(6)向溶液M中通入过量二氧化碳气体,硅酸钠、偏铝酸钠、氢氧化钠都与二氧化碳反应,由溶液M→固体乙这个过程中,硅酸钠和过量二氧化碳反应生成硅酸沉淀和碳酸氢钠,离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(7)KMnO4在酸性条件下与Fe2+进行氧化还原反应的离子方程式为MnO4- + 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O,故答案为:MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O;
(8)利用关系式法计算:
5Fe2+ ~~~~~~~~MnO4-
2×10-3mol 1.000×10-2molL-1×0.01L×4
铁元素的质量为:2×10-3mol×56g/mol=1.12×10-1g,铁元素的质量分数为![]() ×100%=5.6%,故答案为:5.6%。
×100%=5.6%,故答案为:5.6%。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案



