题目内容
3.下列说法正确的是( )| A. | 原子的电子层数越多,原子半径一定越大 | |
| B. | 卤族元素的单质均有氧化性,最高正价都是+7 | |
| C. | 同族元素相差的原子序数可能为16、26、36、46 | |
| D. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
分析 A.原子半径由电子层数、核电荷数等因素共同决定;
B.氟元素是最活泼的非金属元素,无正价;
C.同族元素相差的原子序数可能为2、8、18、32,不可能相差36、46;
D.ⅠA族元素包括氢元素、碱金属元素,ⅦA族元素为活泼非金属元素.
解答 解:A.原子核对核外电子的吸引,核外电子多,相应的核内质子数也多,静电作用力增强影响原子的半径,电子层数多少只是影响原子半径的因素之一,原子电子层数越多,对应的原子半径不一定大,如K比I少一电子层,但半径K比I大,故A错误;
B.氟元素是最活泼的非金属元素,没有正化合价,故B错误;
C.同族元素相差的原子序数可能为2、8、18、32,不可能相差36、46,故C错误;
D.ⅠA族元素包括氢元素、碱金属元素,ⅦA族元素为活泼非金属元素,即可形成共价化合物又可以形成离子化合物,故D正确;
故选D.
点评 本题考查原子核外电子排布,为高频考点,题目难度不大,把握原子核外电子排布规律为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列关于有机物的说法正确的是( )
| A. | 乙烷和新戊烷分子中所含甲基数之比为1:1 | |
| B. | 甲苯能发生加成反应、氧化反应和取代反应 | |
| C. | 聚乙烯能使酸性KMnO4溶液和溴水褪色,但二者原理不同 | |
| D. |  和C4H10的二氯代物的数目相同(不含立体异构) 和C4H10的二氯代物的数目相同(不含立体异构) |
14.根据碳原子成键的特点,碳原子可以相互结合成碳链或碳环.你认为C4H8可能的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
11.下列离子方程式书写正确的是( )
| A. | 钠跟水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 稀盐酸与苏打溶液反应:HCO3-+H+═CO2↑+H2O | |
| C. | 铁盐腐蚀电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | 将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+ )<c(Cl- ) | |
| B. | 向 NH4Cl 溶液中通 NH3,则 c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) | |
| C. | 室温下,c(NH4+ )相同的①(NH4)2 CO3②(NH4)2 SO4 ③(NH4)2 Fe(SO4)2溶液浓度大小顺序为:①>②>③ | |
| D. | 已知 pKa=-lgKa,pKa(HF)=3.1,pKa(C6H5COOH)=4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者 |
8. 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断不正确的是( )| A. | Y、Z组成的化合物只含离子键 | |
| B. | 氢化物的沸点和稳定性排序:R<Y | |
| C. | 最高价氧化物对应的水化物的酸性:T>R | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定显酸性 |
15.下列过程中吸收能量的是( )
| A. |  | B. |  | ||
| C. | 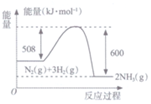 | D. |  |
12.下列叙述正确的是( )
| A. | 吸热反应是指反应物的总能量高于生成物的总能量 | |
| B. | 放热反应是指反应物的总键能高于生成物的总键能 | |
| C. | 核外电子总数相同的电中性原子,一定是同种元素的原子 | |
| D. | 二氧化氮与水反应能生成硝酸,所以二氧化氮是酸性氧化物 |
17.下列关于有机化合物的说法正确的是( )
| A. | C2H4和C4H8一定是同系物 | |
| B. | 氯乙烯和聚乙烯均能发生加成反应 | |
| C. | C3H2Cl6有4种同分异构体 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同 |