题目内容
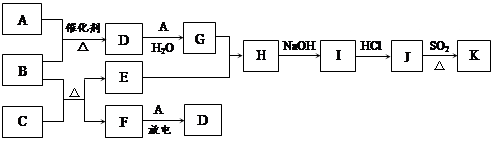
(12分)A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
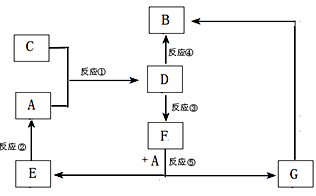
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是 (填序号)。
(2)G生成B有多种途径。若在G的溶液中加入与G等物质的量的Na2O2,恰好使G转化为F,写出该反应的离子方程式:
反应③(即D将某种氧化物氧化为F)的离子方程式
(3)实验室制取C的化学方程式为
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:

(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是 (填序号)。
(2)G生成B有多种途径。若在G的溶液中加入与G等物质的量的Na2O2,恰好使G转化为F,写出该反应的离子方程式:
反应③(即D将某种氧化物氧化为F)的离子方程式
(3)实验室制取C的化学方程式为
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 色 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
(本题12分)
(1)②⑤(2分)
(2) 4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+(2分)
2Fe3++SO2+2 H2O =2Fe2++SO42-+4 H+ (2分)
(3)MnO2 + 4 HCl(浓) Mn Cl2+Cl2↑+2 H2O(2分)
Mn Cl2+Cl2↑+2 H2O(2分)
(1)②⑤(2分)
(2) 4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+(2分)
2Fe3++SO2+2 H2O =2Fe2++SO42-+4 H+ (2分)
(3)MnO2 + 4 HCl(浓)
 Mn Cl2+Cl2↑+2 H2O(2分)
Mn Cl2+Cl2↑+2 H2O(2分)| 实验步骤 | 实验现象 | 用化学用语解释 |
| | 蓝(1分) | Cl2+ 2I-= I2+2Cl-(1分) |
| | | 5Cl2+ I2+6H2O= 2HIO3+10 HCl(2分) |
(1)本题是无机框图题,关键是找准突破点。B为红褐色固体,所以B是氢氧化铁;E为密度最小的气体,则E是氢气;G为浅绿色溶液,因此G中含有亚铁离子。又因为A是金属单质,且A、B、D、G含有同种元素,所以A是铁。D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,所以D是氯化铁,则C是氯气。D能将某种氧化物氧化为F,F是含有三种元素的化合物,所以根据反应⑤可知,F应该是硫酸,因此G是硫酸亚铁。根据转化可知,反应是化合反应,②⑤是置换反应,③是氧化还原反应,④是复分解反应。
(2)过氧化钠溶于水生成氢氧化钠,同时过氧化钠还具有强氧化性,能把亚铁离子氧化生成铁离子,因此该反应的方程式是4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+;铁离子能把SO2氧化生成硫酸,反应的离子方程式是2Fe3++SO2+2 H2O =2Fe2++SO42-+4 H+。
(3)实验室制取氯气的化学方程式是MnO2 + 4 HCl(浓) Mn Cl2+Cl2↑+2 H2O。氯气具有强氧化性,能把碘离子氧化生成单质碘,碘遇淀粉显蓝色,因此反应的方程式是Cl2+ 2I-= I2+2Cl-;当氯气过量时,可以继续氧化单质碘。每消耗0.1mol KI,反应中转移的电子数约为3.612×1023 个,则碘离子失去电子的个数是10×3.612×1023÷6.02×1023 =6,因此碘的化合价从-1价升高到+5价,即氧化物是碘酸,所以反应的方程式是5Cl2+ I2+6H2O= 2HIO3+10 HCl。
Mn Cl2+Cl2↑+2 H2O。氯气具有强氧化性,能把碘离子氧化生成单质碘,碘遇淀粉显蓝色,因此反应的方程式是Cl2+ 2I-= I2+2Cl-;当氯气过量时,可以继续氧化单质碘。每消耗0.1mol KI,反应中转移的电子数约为3.612×1023 个,则碘离子失去电子的个数是10×3.612×1023÷6.02×1023 =6,因此碘的化合价从-1价升高到+5价,即氧化物是碘酸,所以反应的方程式是5Cl2+ I2+6H2O= 2HIO3+10 HCl。
(2)过氧化钠溶于水生成氢氧化钠,同时过氧化钠还具有强氧化性,能把亚铁离子氧化生成铁离子,因此该反应的方程式是4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+;铁离子能把SO2氧化生成硫酸,反应的离子方程式是2Fe3++SO2+2 H2O =2Fe2++SO42-+4 H+。
(3)实验室制取氯气的化学方程式是MnO2 + 4 HCl(浓)
 Mn Cl2+Cl2↑+2 H2O。氯气具有强氧化性,能把碘离子氧化生成单质碘,碘遇淀粉显蓝色,因此反应的方程式是Cl2+ 2I-= I2+2Cl-;当氯气过量时,可以继续氧化单质碘。每消耗0.1mol KI,反应中转移的电子数约为3.612×1023 个,则碘离子失去电子的个数是10×3.612×1023÷6.02×1023 =6,因此碘的化合价从-1价升高到+5价,即氧化物是碘酸,所以反应的方程式是5Cl2+ I2+6H2O= 2HIO3+10 HCl。
Mn Cl2+Cl2↑+2 H2O。氯气具有强氧化性,能把碘离子氧化生成单质碘,碘遇淀粉显蓝色,因此反应的方程式是Cl2+ 2I-= I2+2Cl-;当氯气过量时,可以继续氧化单质碘。每消耗0.1mol KI,反应中转移的电子数约为3.612×1023 个,则碘离子失去电子的个数是10×3.612×1023÷6.02×1023 =6,因此碘的化合价从-1价升高到+5价,即氧化物是碘酸,所以反应的方程式是5Cl2+ I2+6H2O= 2HIO3+10 HCl。
练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目



 ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW