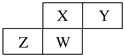
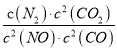题目内容
【题目】如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
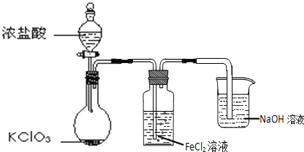
(1)NaOH溶液的作用是______。
(2)实验中,需控制氯气产生的速度,以便使FeCl2溶液转化完全。控制生成氯气速度的操作是______。
(3)开始反应后,在洗气瓶和烧杯所盛放的物质中,被氧化的是______(填化学式)。
(4)烧瓶中发生反应的化学方程式是______。
【答案】 吸收多余的氯气,防止氯气污染环境 旋转分液漏斗的旋塞,调节盐酸滴入的速度 FeCl2 KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
【解析】(1)氯气是大气污染物,因此NaOH溶液的作用是吸收多余的氯气,防止氯气污染环境。(2)装置中含有分液漏斗,则控制生成氯气速度的操作是旋转分液漏斗的旋塞,调节盐酸滴入的速度。(3)氯气与氢氧化钠的反应中,氯气是氧化剂,也是还原剂,氢氧化钠不是氧化剂,也不是还原剂。氯化亚铁易被氯气氧化为氯化铁,因此被氧化的是FeCl2。(4)烧瓶中氯酸钾氧化氯化氢生成氯气,则发生反应的化学方程式是KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O。

练习册系列答案
相关题目