题目内容
【题目】从海水中可以提取溴,主要反应为:2Br﹣+Cl2=2Cl﹣+Br2 , 下列说法正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.氯气发生氧化反应
D.氧化性:Cl2>Br2
【答案】D
【解析】解:A.溴离子化合价处于最低价态,只具有还原性,故A错误; B.反应中Cl元素化合价降低,Cl2为氧化剂,故B错误;
C.Cl2为氧化剂,反应中有元素化合价的升降,为还原反应,故C错误;
D.根据氧化剂氧化性大于氧化产物氧化性可知,氧化性:Cl2>Br2 , 故D正确.
故选D.
反应2Br﹣+Cl2=2Cl﹣+Br2中Cl元素化合价降低,Cl2为氧化剂,Br元素化合价升高,被氧化,Br﹣为还原剂,以此解答该题.

练习册系列答案
相关题目
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
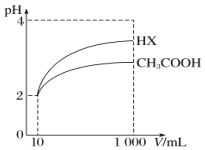
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。