��Ŀ����
����β���к����ϰ��ֲ�ͬ�Ļ�������е���Ⱦ���й�������������һ����̼��������̼��̼�⻯������������Ǧ������������ȣ�һ���γ�һ���ŷŵ��к�����������������3��������NO������������ȼ��ȼ�յĸ�������N2��O2��Ӧ���£�N2(g)+O2(g) 2NO(g) ��H>0����֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K=64��10-4����ش�
2NO(g) ��H>0����֪�÷�Ӧ��2404��ʱ��ƽ�ⳣ��K=64��10-4����ش�
(1)ij�¶��£���4L�ܱ������г���N2��O2��4mol��ƽ��ʱ��5���Ӻ�O2�����ʵ���Ϊ1mol����N2�ķ�Ӧ������____________��
(2)���������£��жϸ÷�Ӧ�ﵽƽ��ı�־��________��(����ĸ���)��
A.����1mol N2ͬʱ����1mol O2 B.��������ܶȲ���
C.�������ƽ����Է����������� D.2v(N2)����v(NO)��
(3)��N2��O2�Ļ�����������º����ܱ������У����б仯������ȷ����________(����ĸ���)��
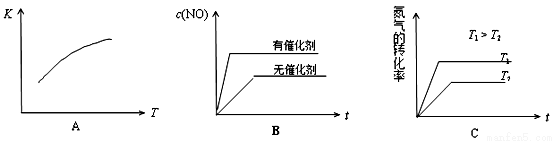
(4)���淴ӦN2(g)+O2(g) 2NO(g)��ƽ�ⳣ������ʽΪ____________���¶����ߣ�ƽ�ⳣ������
2NO(g)��ƽ�ⳣ������ʽΪ____________���¶����ߣ�ƽ�ⳣ������
_____________(�������)
(5)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1mol��L-1��4.0��10-2mol��L-1��3.0��10-3mol��L-1����ʱ��Ӧ___________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��
(6) ���ȼ��N2H4(��)��NO2��ȼ�գ�����N2��Һ̬ˮ����֪��
N2(g)+2O2(g)��2NO2(g) ��H1��+67kJ/mol
N2H4(g)+O2(g)��N2(g)+2H2O(l) ��H2��-534kJ/mol
�ɴ���д��������ʱȼ�շ�Ӧ���Ȼ�ѧ����ʽ____________________��
ijʵ��С����0.50 mol/L NaOH��Һ��0.50 mol/L������Һ�����к��ȵIJⶨ��

������0.50 mol/L NaOH��Һ
��ʵ���д�ԼҪʹ��245 mL NaOH��Һ��������Ҫ����NaOH����_____g��
�ⶨϡ�����ϡ���������к��ȵ�ʵ��װ����ͼ��ʾ��
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ���к���Ϊ57.3 kJ/mol����_____________��
��2��ȡ50 mL NaOH��Һ��30 mL������Һ����ʵ�飬ʵ���������±���
������д�±��еĿհף�
��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ ��t2-t1��/�� | |||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�ڽ�����Ϊ0.50 mol/L NaOH��Һ��0.50 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c=4.18 J/(g�����������к��ȡ�H=______________ȡС�����һλ����
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ������ǣ�______��
A��ʵ��װ�ñ��¡�����Ч����
B����ȡNaOH��Һ�����ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�


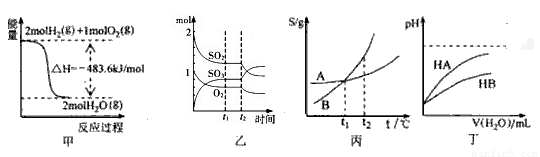
 2SO3���ɷֵ����ʵ����仯��t2ʱ�̸ı������һ������С�������
2SO3���ɷֵ����ʵ����仯��t2ʱ�̸ı������һ������С������� K��+NaCl
K��+NaCl