题目内容
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。

Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 平衡时,若向容器①中再加入0.2molCO和0.2molCO2,则V正<V逆
C. Q=8.2
D. 容器①中CO的转化率与容器②中CO2的转化率之和为1


 2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答: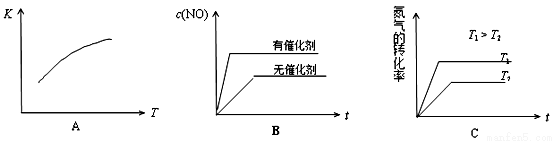
 2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法: